��Ŀ����
����Ŀ����ͭ��CuFeS2������ȡͭ���仯�������Ҫԭ��֮һ�������Ʊ������Ļ����ұ��ͭ�ķ�ӦΪ8CuFeS2+21O2 ![]() 8Cu+4FeO+2Fe2O3+16SO2 ��
8Cu+4FeO+2Fe2O3+16SO2 ��
��1����CuFeS2��Fe�Ļ��ϼ�Ϊ+2����Ӧ�б���ԭ��Ԫ��������Ԫ�ط��ţ���
��2����ϡH2SO4����������Ӧ��ȡͭ��ʣ��Ĺ��������ȡ����������Һ��������Һ�д��� Fe3+�ķ�������ע���Լ�������
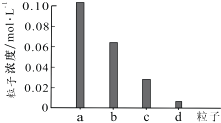
��3������ұ�����̲�������SO2 �� ���д��������к�������������ţ� a���߿��ŷ� b�������Ʊ����� c���ô�����Һ������Na2SO3 d����Ũ��������
��4����֤��ͭ��ұ��ͭ�ķ�Ӧ�������к���SO2�ķ����� ��
��5��ʵ�����Ʊ����ռ������SO2 �� �����������£� 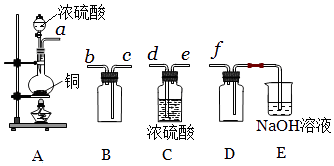
������װ��A����SO2 �� ��Ӧ�Ļ�ѧ����ʽΪ ��
���밴�����������Ӹ������ӿڣ�˳��Ϊa��������f��
װ��E��NaOH��Һ�������� �� E�з�Ӧ�����ӷ���ʽ ��
���𰸡�
��1��Cu��O
��2��ȡ������Һ,�μ�KSCN��Һ,��Һ���
��3��bc
��4��������ͨ��Ʒ����Һ��,���Ʒ����Һ��ɫ,���Ⱥ��ֱ��,��֤����SO2
��5��Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O�� d�� e�� b�� c�����ն����SO2,��ֹ��Ⱦ������ SO2+2OH=SO32++H2O
CuSO4+SO2��+2H2O�� d�� e�� b�� c�����ն����SO2,��ֹ��Ⱦ������ SO2+2OH=SO32++H2O
���������⣺��1��8CuFeS2+21O2 ![]() 8Cu+4FeO+2Fe2O3+16SO2�У�CuԪ�صĻ��ϼ���+2�۽���Ϊ0��OԪ�صĻ��ϼ���0����Ϊ��2�ۣ����ϼ۽��͵�Ԫ�ر���ԭ����Cu��O����ԭ��
8Cu+4FeO+2Fe2O3+16SO2�У�CuԪ�صĻ��ϼ���+2�۽���Ϊ0��OԪ�صĻ��ϼ���0����Ϊ��2�ۣ����ϼ۽��͵�Ԫ�ر���ԭ����Cu��O����ԭ��
���Դ��ǣ�Cu��O����2����ϡH2SO4����������Ӧ��ȡͭ��ʣ��Ĺ��������ȡ����������Һ��������Һ�д���Fe3+�ķ�����ȡ������Һ���μ�KSCN��Һ����Һ��죻
���Դ��ǣ�ȡ������Һ���μ�KSCN��Һ����Һ��죻��3����������Ϊ������Ⱦ����ܸ߿��ŷţ���Ũ�����Ӧ���������Ʊ�������������Σ�ֻ��bc���ϣ�
���Դ��ǣ�bc����4����֤��ͭ��ұ��ͭ�ķ�Ӧ�������к���SO2�ķ����ǽ�����ͨ��Ʒ����Һ�У����Ʒ����Һ��ɫ�����Ⱥ��ֱ�죬��֤����SO2��
���Դ��ǣ�������ͨ��Ʒ����Һ�У����Ʒ����Һ��ɫ�����Ⱥ��ֱ�죬��֤����SO2����5����װ��A����SO2����Ӧ�Ļ�ѧ����ʽΪCu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O��
CuSO4+SO2��+2H2O��
���Դ��ǣ�Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O��
CuSO4+SO2��+2H2O��
�ڸ���װ��AΪ��Ӧװ�ã�CΪ����װ�ã�BΪ�ռ�װ�ã�DΪ��ֹ������EΪβ���������������������Ӹ������ӿڣ�˳��Ϊa��d��e��c��b��f��װ��E��NaOH��Һ�����������ն����SO2����ֹ��Ⱦ���������������ӷ���ʽΪ��SO2+2OH=SO32++H2O��
���Դ��ǣ�d��e��c��b�����ն����SO2����ֹ��Ⱦ������SO2+2OH=SO32++H2O��