��Ŀ����
1��һ������﮵���ǽ���ѧʽΪLi4Ti5O12��������Ϊ��ص��������ϣ��ڷŵ�Ĺ����б�Ϊ��ѧʽΪLi4Ti5O12�����ʡ�
��Li4Ti5O12��TiԪ�صĻ��ϼ�Ϊ ��﮵�ص�ͻ���ŵ��� ��
�ڸ�﮵����һ�ֶ��ε�أ��ŵ�ʱ�ĸ�����ӦʽΪ �����ʱ��������ӦʽΪ ��
��2����������ԭ�ζ����ⶨ�Ʊ��õ���TiO2�����е�TiO2��������������һ�������£���TiO2�ܽⲢ��ԭΪTi3+������KSCN��Һ��Ϊָʾ������NH4Fe��SO4��2����Һ�ζ�Ti3+��ȫ������Ti4+��
��TiCl4ˮ������TiO2��xH2O�Ļ�ѧ����ʽΪ ��
�ڵζ��յ�������� ��
�۵ζ�����ʱ����ȡTiO2����0��2g������0.1mol��L-1 NH4Fe��SO4��2����Һ20ml����TiO2����������Ϊ____ ��
�����ڵζ��յ㣬��ȡ�ζ��̶ܿ�ʱ�����ӱ���Һ��Һ�棬ʹ��ⶨ��� ���ƫ����ƫС������Ӱ�족��o
��3����֪��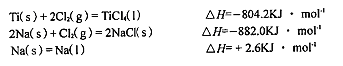
��TiCl4��I��+4Na��l��=Ti��s��+4NaCl��s���ġ�H= KJ��mol-1��
��1����+4(1��)���С���������ߡ�Я�����㡣��1�֣�
��Li-e-=Li+��1�֣�Li7Ti5O12-3e-=Li4Ti5O12+3Li+��2�֣�
��2����TiCl4+(x+2)H2O=TiO2?xH2O��+4HCl��2�֣�����Һ��ɺ�ɫ(1��)
��80%��2�֣���ƫС��1�֣�
��3��-970.2��2�֣�
������1���ٸ��ݻ����ﻯ�ϼ۴����͵����㣬�Ϊ+1�ۣ���Ϊ-2�ۣ�����Ϊ+4�ۣ��ڷŵ緢��ԭ��ط�Ӧ������Li-e-=Li+����緢�����ط�Ӧ����������ӵ�Դ����������ʧȥ���ӣ�����������Ӧ��Li7Ti5O12-3e-=Li4Ti5O12+3Li+��
��2����TiCl4ˮ������TiO2?xH2O������TiO2�Ļ�ѧʽ��Ӧ��2molˮ���뷴Ӧ���ʷ���ʽΪTiCl4+(x+2)H2O=TiO2?xH2O��+4HCl����n(NH4Fe��SO4��2)=0.1mol/L��0.02L=0.002mol,�˷�Ӧ��������ԭ��Ӧ�����ݵ��ӵ�ʧ�غ㣬n(NH4Fe��SO4��2)=n(TiO2),m(TiO2)=0.002mol��80g��mol-1,0.002��80/0.2=0.80���ܵζ��յ㣬���Ӷ�������������ֵƫ���������ֵƫС���ʲⶨ���ƫ�͡���3�����ݸ�˹���ɣ������еķ���ʽ��ϾͿɵõ������
TiCl4(l)=Ti(s)+2Cl2(g),��H=804.2KJ��mol-
4Na(s)+2Cl2(g)="4NaCl(s)" ��H=-2��882.0KJ��mol-
4Na(l)="4Na(s)" ��H=-4��2.6KJ��mol-
����������ӣ��͵õ���H=-970.2KJ��mol-

�ҹ��Ǹ��������,��������Ϊ�����һ,��¯��������Ϊ�ձ����������.
I. ��֪��2CO(g)+ O2(g)��2CO2(g),��H��-566 kJ��mol-1
2Fe(s)+ 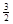 O2(g)��Fe2O3(s),��H��-825.5 kJ��mol-1
O2(g)��Fe2O3(s),��H��-825.5 kJ��mol-1 ��Ӧ��Fe2O3(s)+ 3CO(g)
��Ӧ��Fe2O3(s)+ 3CO(g) 2Fe(s)+ 3CO2(g),��H��______ kJ��mol-1.
2Fe(s)+ 3CO2(g),��H��______ kJ��mol-1.
��. ��Ӧ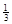 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
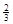 Fe(s)+ CO2(g)��1000���ƽ�ⳣ������4.��һ���ݻ�Ϊ10L���ܱ�������,1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol,��Ӧ����l0min��ﵽƽ��.
Fe(s)+ CO2(g)��1000���ƽ�ⳣ������4.��һ���ݻ�Ϊ10L���ܱ�������,1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol,��Ӧ����l0min��ﵽƽ��.
��1��CO��ƽ��ת����=____________.
��2�������CO��ƽ��ת����,�ٽ�Fe2O3��ת��,�ɲ�ȡ�Ĵ�ʩ��________.
a����߷�Ӧ�¶�
b������Ӧ��ϵ��ѹǿ
c��ѡȡ���ʵĴ���
d����ʱ���ջ��Ƴ�����CO2
e�������ʯ,ʹ����ƽ���������ֽӴ�
��.��¯���������ķ����е�CO�ɽ��л���,ʹ����һ�������º�H2��Ӧ�Ʊ��״�:
CO(g)+ 2H2(g) CH3OH(g).�����ͼʾ�ش���������:
CH3OH(g).�����ͼʾ�ش���������: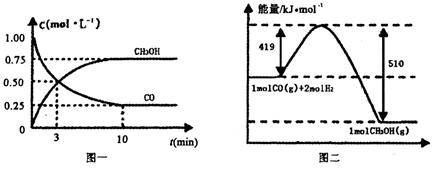
��1���ӷ�Ӧ��ʼ��ƽ��,��H2Ũ�ȱ仯��ʾƽ����Ӧ����v(H2)=________.
��2�������¶Ⱥ�������ͬ�������ܱ�������,����ͬ��ʽͶ�뷴Ӧ��,��÷�Ӧ�ﵽƽ�ⅼ���й��������±���
| ���� | ��Ӧ��Ͷ����� | ��Ӧ��� ת���� | CH3OH��Ũ�� | �����仯 (Q1��Q2��Q3������0) |
| �� | 1mol CO��2mol H2 | ��1 | c1 | �ų�Q1kJ���� |
| �� | 1mol CH3OH | ��2 | c2 | ����Q2kJ���� |
| �� | 2mol CO��4mol H2 | ��3 | c3 | �ų�Q3kJ���� |
�����й�ϵ��ȷ����________.
A��c1=c2
B��2Q1=Q3
C��2a1=a3
D��a1 +a2 =1
E���÷�Ӧ������1mol CH3OH����ų�(Q1+Q2)kJ����
��3������һ����ɱ���ܱ������г���l molCO��2molH2��1molCH3OH,�ﵽƽ�ⅼ��û��������ܶ���ͬ��ͬѹ����ʼ��1.6��,��÷�Ӧ��________(����������桱)��Ӧ�����ƶ�.
��4���״�������������ȼ�ϵ��,�õ���ö�Ķ��Ե缫����Ũ����������Һ,д���õ�صĸ�����Ӧʽ______________________.
��ѧ��Ӧ�仯���̼�������о�����Ҫ��ش����⣺
��1�����ڷ�Ӧ�����������仯���о���
��2CO��g��+O2��g��=2CO2��g����H= kJ��mol-1��
��2�����ڷ�Ӧ���ʺ��ȵ��о���
��ҵ�������ص�ԭ������NH3��CO2Ϊԭ�Ϻϳ�����[CO(NH2)2]����Ӧ�Ļ�ѧ����ʽΪ��
2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l)���÷�Ӧ��ƽ�ⳣ����K�����¶ȣ�T / �棩��ϵ���£�
CO(NH2)2 (l) + H2O (l)���÷�Ӧ��ƽ�ⳣ����K�����¶ȣ�T / �棩��ϵ���£�
| T / �� | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
���ʱ䦤H _______0 ���>������<����=������
����һ���¶Ⱥ�ѹǿ�£���ԭ�����е�NH3��CO2�����ʵ���֮�ȣ���̼�ȣ�
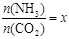 ����ͼ��1���ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ���� ��
����ͼ��1���ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ���� ��
����ͼ�е�B�㴦��NH3��ƽ��ת����Ϊ ��
��3�����ڵ绯ѧ���о���
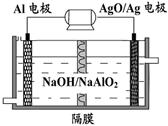
�����ճ���������;���Ľ���Ԫ�أ���ͼΪAl-AgO��صĹ����ͼ���������ҺΪNaOH����������ˮ�¶�����Դ���õ�������缫��ӦʽΪ ���øõ�ص������[CO(NH2)2]�ļ�����Һ�����װ��ʾ��ͼ����ͼ�������и�Ĥ����ֹ����ͨ��������������Ϊ���Ե缫�������ʱ�������ĵ缫��ӦʽΪ ��

��4�����ڵ���ƽ����о���
����ѪҺ�������Ҫ�����ƽ�⣺
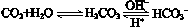 ��ʹ����ѪҺpH������7.35��7.45������ͻᷢ�����ж�����ж�����pH��c(HCO3-)��c(H2CO3)�仯��ϵ���±���
��ʹ����ѪҺpH������7.35��7.45������ͻᷢ�����ж�����ж�����pH��c(HCO3-)��c(H2CO3)�仯��ϵ���±���| c(HCO3-)��c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
�Իش�
��������ѪҺ�У�HCO3-��ˮ��̶� ����̶ȣ�����ڡ�����С�ڡ��������ڡ�����
������ѪҺ���ж�ʱ����ע�仺�� ����ѡ���
A��NaOH��Һ B��NaHCO3��Һ C��NaCl��Һ D��Na2SO4��Һ
�� pH=7.00��ѪҺ�У�c(H2CO3) c(HCO3��) ���<������>������������
���ǵ����Ϻ����ḻ��һ��Ԫ�أ���Ԫ�صĵ��ʺͻ������ڹ�ũҵ����������������Ҫ��;��
��1���������������仯ʾ��ͼ��
д��CO��NO2��Ӧ����NO��CO2���Ȼ�ѧ����ʽ
��2���ڹ̶�������ܱ������У��������»�ѧ��Ӧ��N2(g)+3H2(g)  2NH3 (g) ��H<0��
2NH3 (g) ��H<0��
��ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±������ж�K1 K2���>������=����<����
| T /K | 298 | 398 |
| ƽ�ⳣ��K | K1 | K2 |
��3�����и�����˵���÷�Ӧ�ﵽƽ��״̬���� ������ĸ��ţ�
a�� v(H2)��="3" v(N2)��
b�� ������ѹǿ���ֲ���
c�� �����л��������ܶȱ��ֲ���
d.�� N2��H2��NH3��Ũ��֮��Ϊ1:3:2
��4��������������ˮ,������ͼʵ������֤,�ڱ�״����,��ƿ�еİ�ˮʹ��̪��졣
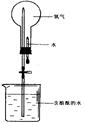
��ش�
���û�ѧ����˵�����ð�ˮ��ʹ��̪����ԭ�� ��
��250Cʱ����һ�����İ�ˮ�������Ϻ�pH=7����û����Һ��c(Cl-)��c(NH4+)��ϵΪ ������ĸ��ţ�
a��c(Cl-)��c(NH4+) b��c(Cl-)��c(NH4+)
c�� c(Cl-)��c(NH4+) d.���ж�
CO2��CH4��������Ҫ���������壬ͨ��CH4��CO2��Ӧ�������ֵ��ѧƷ��Ŀǰ���о�Ŀ�ꡣ
��1��250��ʱ�������Ͻ�Ϊ��������4 L������ͨ��6 mol CO2��6 mol CH4���������·�Ӧ��CO2(g)��CH4(g) 2CO(g)��2H2(g)��ƽ����ϵ�и��������������±���
2CO(g)��2H2(g)��ƽ����ϵ�и��������������±���
| ���� | CH4 | CO2 | CO | H2 |
| ������� | 0.1 | 0.1 | 0.4 | 0.4 |
�ٴ��¶��¸÷�Ӧ��ƽ�ⳣ��K= ��
����֪��CH4(g)��2O2(g)��CO2(g)��2H2O(g) ��H="-890.3" kJ��mol��1
CO(g)��H2O (g)��CO2(g)��H2 (g) ��H="2.8" kJ��mol��1
2CO(g)��O2(g)��2CO2(g) ��H="-566.0" kJ��mol��1
��ӦCO2(g)��CH4(g)
 2CO(g)��2H2(g) �ġ�H= ��
2CO(g)��2H2(g) �ġ�H= ����2���Զ������ѱ��渲��Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת�������ᡣ
���ڲ�ͬ�¶��´����Ĵ�Ч�������������������ͼ��ʾ��250��300��ʱ���¶����߶�������������ʽ��͵�ԭ���� ��
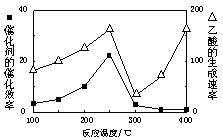
��Ϊ����߸÷�Ӧ��CH4��ת���ʣ����Բ�ȡ�Ĵ�ʩ�� ��
�۽�Cu2Al2O4�ܽ���ϡ�����е����ӷ���ʽΪ ��
��3����CO2Ϊԭ�Ͽ��Ժϳɶ������ʡ�
�پ�̼������һ����������ͺϳɲ��ϣ������ɼӾ۶��ɡ�д����̼�����Ľṹ��ʽ�� ��
������������ˮ��Һ������ʽ��е�⣬CO2��ͭ�缫�Ͽ�ת��Ϊ���飬�õ缫��Ӧ����ʽΪ ��
Ϊ��СCO2�Ի�����Ӱ�죬���������ŷ�����ͬʱ��Ӧ��ǿ��CO2�������õ��о���
��1���ٰѺ��нϸ�Ũ��CO2�Ŀ���ͨ�뱥��K2CO3��Һ�����ڢٵ�����Һ��ͨ����ˮ�����õ���Ũ�ȵ�CO2���塣д�����з�Ӧ�Ļ�ѧ����ʽ__________________________��
��2���罫CO2��H2��1:3������Ȼ�ϡ�
���ʵ������ºϳ�ij����ˮ�������� ������ţ���
| A������ | B��ϩ�� | C��Ȳ�� | D������ͬϵ�� |
 CH3OH(g)+H2O(g) ��H=��49.0 kJ/mol�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
CH3OH(g)+H2O(g) ��H=��49.0 kJ/mol�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
�ӷ�Ӧ��ʼ��ƽ�⣬v(H2)= ��������ת����= ����ʹƽ����ϵ��n(CH3OH)����Ĵ�ʩ��__________________________________________________��
��3���罫CO2��H2��1:4������Ȼ�ϣ����ʵ��������¿��Ƶ�CH4����֪��
CH4 (g) +2O2(g)=CO2(g)+2H2O(l) ��H1="�D890.3" kJ/mol
H2(g) + 1/2O2(g)=H2O(l) ��H2=��285.8 kJ/mol
��CO2(g)��H2(g)��Ӧ����CH4(g)��Һ̬ˮ���Ȼ�ѧ����ʽ��____________________��
��4��ijͬѧ�ó������ⶨ���нϸ�Ũ��CO2�Ŀ�����CO2�ĺ����������һЩ������20����������±���
| �ܽ�ȣ�S��/g | �ܶȻ���Ksp�� | ||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9��10��9 | 2.6��10��9 |
��˵����KspԽС����ʾ��������ˮ��Һ��Խ�׳�����
����CO2����ʵ��Լ��� (�Ca(OH)2����Ba(OH)2��)��Һ��ʵ��ʱ����Ҫ�ⶨ��ҵ���������������ɱ�״�����⣬����Ҫ�ⶨ ��
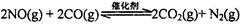 �����ܱ������з����÷�Ӧʱ��c��CO2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯���ߣ���ͼ��ʾ���ݴ��жϣ�
�����ܱ������з����÷�Ӧʱ��c��CO2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯���ߣ���ͼ��ʾ���ݴ��жϣ�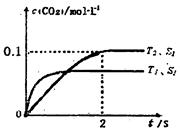
 N2(g)��CO2(g)ij�о�С��������ܱ���������һ�����Ļ���̿��NO�����£�T��C)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ������
N2(g)��CO2(g)ij�о�С��������ܱ���������һ�����Ļ���̿��NO�����£�T��C)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ������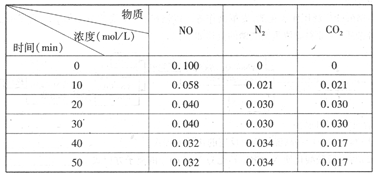
 N2��2CO2 ��H<0�о���������ʹ�õ���������ʱ����������ıȱ���������ѧ��Ӧ���ʣ�Ϊ�˷ֱ���֤�¶ȡ������ıȱ�����Ի�ѧ�� Ӧ���ʵ�Ӱ����ɡ�ijͬѧ���������ʵ�飬����ʵ�������Ѿ������±��С�
N2��2CO2 ��H<0�о���������ʹ�õ���������ʱ����������ıȱ���������ѧ��Ӧ���ʣ�Ϊ�˷ֱ���֤�¶ȡ������ıȱ�����Ի�ѧ�� Ӧ���ʵ�Ӱ����ɡ�ijͬѧ���������ʵ�飬����ʵ�������Ѿ������±��С�

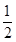 O2(g)= CO2(g)+2H2(g)����H2
O2(g)= CO2(g)+2H2(g)����H2