题目内容
【题目】废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:
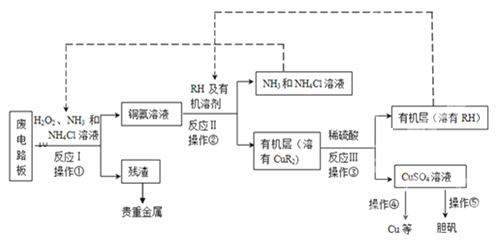
回答下列问题:
(1)反应I是将Cu转化为Cu(NH3)42+,反应中H2O2 的作用是_________________。请写出操作①的名称:________________。
(2)反应II是铜氨溶液中的Cu(NH3)42+与有机物RH反应,请写出该反应的离子方程式:_________________。操作②用到的主要仪器名称为___________,其目的是(填序号)__________。
a.富集铜元素 b.使铜元素与水溶液中的物质分离 c.增加Cu2+在水中的溶解度
(3)反应III除了生成CuSO4之外,还生成另外一种产物是___________。
(4)操作④以石墨作电极电解CuSO4溶液,电解时的总反应式为________________。操作⑤由硫酸铜溶液制胆矾的主要步骤是___________________________________。
(5)流程中有三次实现试剂的循环使用,已用虚线标出两处,第三处的试剂是______。循环使用的NH4Cl在反应I中的主要作用是__________________________。
【答案】 作氧化剂 过滤 Cu(NH3)42++2RH=2NH4++2NH3+CuR2 分液漏斗 a b RH 2CuSO4+2H2O=2Cu+O2↑+2H2SO4 蒸发浓缩 冷却结晶 过滤洗涤 H2SO4 防止由于溶液中的c(OH-)过高,生成Cu(OH)2沉淀
【解析】(1)反应I中Cu被氧化为Cu(NH3)42+,所以反应中H2O2 的作用是作氧化剂。操作①是过滤。
(2)反应II是铜氨溶液中的Cu(NH3)42+与有机物RH反应,该反应的离子方程式为Cu(NH3)42++2RH=2NH4++2NH3+CuR2。操作②是萃取和分液,用到的主要仪器是分液漏斗,其目的是富集铜元素和使铜元素与水溶液中的物质分离,填a b。
(3)由流程可知,反应III除了生成CuSO4之外,还生成另外一种产物是RH。
(4)操作④以石墨作电极电解CuSO4溶液,电解时的总反应式为2CuSO4+2H2O=2Cu+O2↑+2H2SO4。操作⑤由硫酸铜溶液制胆矾的主要步骤是蒸发浓缩、冷却结晶、过滤、洗涤。
(5)流程中有三次实现试剂的循环使用,已用虚线标出两处,第三处是操作④以石墨作电极电解CuSO4溶液所产生的H2SO4可以循环使用到反应III中。循环使用的NH4Cl在反应I中的主要作用是防止由于溶液中的c(OH-)过高,生成Cu(OH)2沉淀。

 阅读快车系列答案
阅读快车系列答案【题目】用如图装置来分离CO2和CO混合气体并干燥,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为()
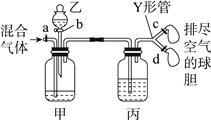
甲 | 乙 | 丙 | |
A | 饱和NaHCO3溶液 | 12 mol·L-1盐酸 | 18.4 mol·L-1 H2SO4 |
B | 饱和Na2CO3溶液 | 2 mol·L-1 H2SO4 | 饱和NaOH溶液 |
C | 饱和NaOH溶液 | 2 mol·L-1 H2SO4 | 18.4 mol·L-1 H2SO4 |
D | 18.4 mol·L-1 H2SO4 | 饱和NaOH溶液 | 18.4 mol·L-1 H2SO4 |
A. A B. B C. C D. D