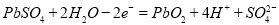题目内容
已知二元酸H2A在水中存在以下电离:H2A==H++HA-,HA- H++A2-,回答下列问题:
H++A2-,回答下列问题:
(1)Na2A溶液呈________性,理由是___________(用离子方程式表示)。
(2)NaHA溶液呈________性,理由是___________。
(3)0.1mol/L的NaHA溶液的PH=3,则Ka(HA-)=_____________。
(4)某温度下,向10 mL 0.1 mol/L NaHA溶液中加入0.1 mol/L KOH溶液V mL至溶液中水的离子积常数Ka=c2(OH-),此时溶液呈___________性,V____________10 (填“<”“>”或“=”)c(K+)/c(Na+) ____________1(填“<”“>”或“=”),溶液中电荷守恒等式为____________。
练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目


 要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为
要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O 反应得到4molCH3COOH和1molB.下列说法错误的是
反应得到4molCH3COOH和1molB.下列说法错误的是 CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1 能源甲醇,反应:CO(g)+2H2(g)
能源甲醇,反应:CO(g)+2H2(g)