题目内容
合成氨的流程示意图如下:
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是____________、____________;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学方程式________________________,__________________________。
(2)设备A中含有电加热器,触媒和热交换器,设备A的名称是________,其中发生的化学反应方程式为__________________________。
(3)设备B的名称为________,其中m和n是两个通水口,入水口是________(填“m”或“n”)。不宜从相反方向通水的原因是________________________________________。
(4)设备C的作用是____________________________________________。
(5)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
已知1 000 K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中c(H2O)∶c(CO)不低于________。
(1)液化、分馏 与C反应后除去CO2 C+H2O(g) CO+H2 CH4+H2O(g)
CO+H2 CH4+H2O(g) CO+3H2 (2)合成塔 N2+3H2
CO+3H2 (2)合成塔 N2+3H2 2NH3 (3)冷却塔 n 高温气体由冷却塔的上端进入,冷却水应从下端进入,逆向冷却效果好 (4)将液氨和未反应的原料气分离
2NH3 (3)冷却塔 n 高温气体由冷却塔的上端进入,冷却水应从下端进入,逆向冷却效果好 (4)将液氨和未反应的原料气分离
(5)13.8
解析

氮的固定有三种途径:生物固氮、自然固氮和工业固氮。根据最新“人工固氮”的研究报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间1 h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
 4NH3(g)+3O2(g)ΔH=a kJ·mol-1
4NH3(g)+3O2(g)ΔH=a kJ·mol-1回答下列问题:
(1)此合成反应的a________0;ΔS________0,(填“>”、“<”或“=”)
(2)已知:N2(g)+3H2(g)
 2NH3(g) ΔH=-92 .4 kJ·mol-1
2NH3(g) ΔH=-92 .4 kJ·mol-12H2(g)+O2(g) ===2H2O(l) ΔH =-571.6 kJ·mol-1
则2N2(g)+6H2O(l)===4NH3(g)+3O2 (g) ΔH=________kJ·mol-1
(3)从323 K到353 K,氨气的生成量减少的可能原因_________________;
(4)工业合成氨的反应为N2(g)+3H2(g)
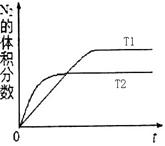
 2NH3(g) ΔH=-92 .4 kJ·mol-1,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:
2NH3(g) ΔH=-92 .4 kJ·mol-1,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答: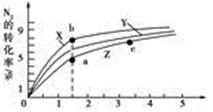
①在上述三种温度中,曲线X对应的温度是________。
②a、b、c三点H2的转化率最小的是________点、转化率最大的是________点。
③在容积为1.0 L的密闭容器中充入0.30 mol N2(g)和0.80 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。该条件下反应2NH3(g)
 N2(g)+3H2(g)的平衡常数为________ 。
N2(g)+3H2(g)的平衡常数为________ 。 硫酸工业在国民经济中占有极其重要的地位。请回答硫酸工业中的如下问题:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 郊
区(填标号);
| A.有丰富黄铁矿资源的城市 | B.风光秀丽的旅游城市 |
| C.消耗硫酸甚多的工业城市 | D.人口稠密的文化、商业中心城市 |
该反应的化学方程式为 。
(3)为提高SO3吸收率,实际生产中通常用 吸收SO3。
(4)已知反应2SO2+O2
 SO3 △H <0,现将0.050mol SO2和0.030mol O2
SO3 △H <0,现将0.050mol SO2和0.030mol O2充入容积为1L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压
强缩小到原来压强的75%,则该条件下SO2的转化率为________;该条件下的
平衡常数为__________。
(5)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在
沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
温度升高而降低的原因 。
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方
法可用 (填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产
水泥的辅料,写出这两步反应的化学方程式 。
硫元素的化合物在生产、生活中有着广泛的应用。
(1)400℃,1.01×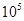 Pa下,容积为1.0L的密闭容器中充入0.5molSO2, (g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g)
Pa下,容积为1.0L的密闭容器中充入0.5molSO2, (g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g) 2SO3(g) △H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示
2SO3(g) △H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示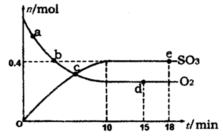 。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
| A.a点时刻的正反应速率比b点时刻的大 |
| B.c点时刻反应达到平衡状态 |
| C.d点和e点时刻的c(O2)相同 |
| D.若5 00℃,1.01×105Pa下,反应达到平衡时,n( SO3) 比图中e点时刻的值大 |
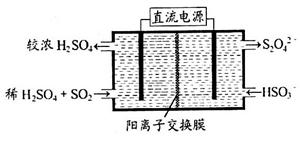
(3)可通过电解法使(2)中的吸收液再生而循环利用(电极均为石墨电极),其工作示意图如下:
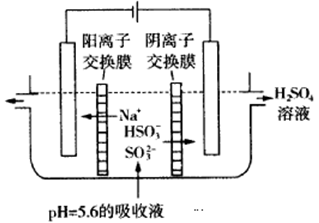
HSO3-在阳极室反应的电极反应式为________________________,阴极室的产物_________________。
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OH CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有:__________、__________等。
(2)若用如图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为________、________等。
(3)此反应以浓硫酸为催化剂,可能会造成__________、__________等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
| 同一反应时间 | | 同一反应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%)* | | 反应时间/h | 转化率(%) | 选择性(%)* |
| 40 | 77.8 | 100 | | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | | 6 | 93.0 | 100 |
①根据表中数据,下列________(填字母)为该反应的最佳条件。
A.120 ℃,4 h B.80 ℃,2 h
C.60 ℃,4 h D.40 ℃,3 h
②当反应温度达到120 ℃时,反应选择性降低的原因可能为________。
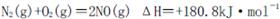 是导致汽车尾 气中含有NO的重要原因之一。
是导致汽车尾 气中含有NO的重要原因之一。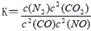 ,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表
,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表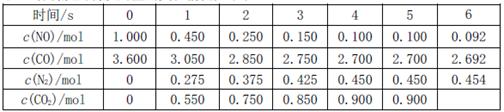
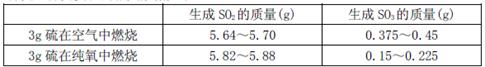
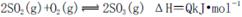 向右移动
向右移动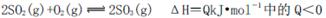
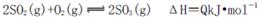 向右移动
向右移动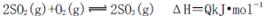 向右移动
向右移动 时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g)
时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g) 2NO2(g),经5min达到平衡,测得c(NO)="0.5" mol/L,并放热QkJ。5min内 v(O2)=___________。
2NO2(g),经5min达到平衡,测得c(NO)="0.5" mol/L,并放热QkJ。5min内 v(O2)=___________。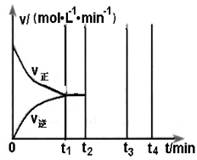
 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。