题目内容
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
请回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应为 反应。(填“吸热”或“放热”)
(3)800℃时,固定容积的密闭容器中放入混合物,起始浓度为c(CO)=0.01 mol·L-1,c(H2O)=0.03 mol·L-1,c(CO2)=0.01 mol·L-1,c(H2)=0.05 mol·L-1,则反应开始时,H2O的消耗速率比生成速率 (填“大”、“小”或“不能确定”)
(4)830℃时,在1L的固定容积的密闭容器中放入2mol CO2和1mol H2,平衡后CO2的转化率为 ,H2的转化率为 。
 CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式K= 。
(2)该反应为 反应。(填“吸热”或“放热”)
(3)800℃时,固定容积的密闭容器中放入混合物,起始浓度为c(CO)=0.01 mol·L-1,c(H2O)=0.03 mol·L-1,c(CO2)=0.01 mol·L-1,c(H2)=0.05 mol·L-1,则反应开始时,H2O的消耗速率比生成速率 (填“大”、“小”或“不能确定”)
(4)830℃时,在1L的固定容积的密闭容器中放入2mol CO2和1mol H2,平衡后CO2的转化率为 ,H2的转化率为 。
(1)KK=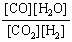 ;(2)吸热;(3)小;(4)CO2的转化率为1/3,H2的转化率为2/3。
;(2)吸热;(3)小;(4)CO2的转化率为1/3,H2的转化率为2/3。
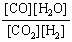 ;(2)吸热;(3)小;(4)CO2的转化率为1/3,H2的转化率为2/3。
;(2)吸热;(3)小;(4)CO2的转化率为1/3,H2的转化率为2/3。本题是对化学平衡常数含义及平衡转化率的考查。解决此类问题要紧扣平衡常数的概念。由平衡常数的含义知该反应的平衡常数K的表达式为K=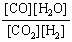 ;可逆反应的平衡常数一般只随温度的改变而改变,吸热反应的平衡常数随温度升高而增大,放热反应的平衡常数随温度升高而减小;由表中的数据知该反应随温度的升高而增大,可推知升高温度,平衡向正反应方向移动,所以该反应为吸热反应。把起始浓度代入平衡常数的表达式中,其比值小于800℃时的K值,则反映将向正反应方向移动,H2O的消耗速率比生成速率小;830℃时,平衡常数为,设反应中转化的CO2浓度为x,则反映过程中的物质浓度的变化情况为:
;可逆反应的平衡常数一般只随温度的改变而改变,吸热反应的平衡常数随温度升高而增大,放热反应的平衡常数随温度升高而减小;由表中的数据知该反应随温度的升高而增大,可推知升高温度,平衡向正反应方向移动,所以该反应为吸热反应。把起始浓度代入平衡常数的表达式中,其比值小于800℃时的K值,则反映将向正反应方向移动,H2O的消耗速率比生成速率小;830℃时,平衡常数为,设反应中转化的CO2浓度为x,则反映过程中的物质浓度的变化情况为:
CO2(g) + H2(g) CO(g) + H2O(g)
CO(g) + H2O(g)
起始时(mol·L-1) 2 1 0 0
转化了(mol·L-1) x x x x
平衡时(mol·L-1) 2-x 1-x x x
依据平衡常数的关系可得:(2-x)(1-x)=x·x,解得x=2/3,则平衡后CO2的转化率为1/3,H2的转化率为2/3。
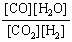 ;可逆反应的平衡常数一般只随温度的改变而改变,吸热反应的平衡常数随温度升高而增大,放热反应的平衡常数随温度升高而减小;由表中的数据知该反应随温度的升高而增大,可推知升高温度,平衡向正反应方向移动,所以该反应为吸热反应。把起始浓度代入平衡常数的表达式中,其比值小于800℃时的K值,则反映将向正反应方向移动,H2O的消耗速率比生成速率小;830℃时,平衡常数为,设反应中转化的CO2浓度为x,则反映过程中的物质浓度的变化情况为:
;可逆反应的平衡常数一般只随温度的改变而改变,吸热反应的平衡常数随温度升高而增大,放热反应的平衡常数随温度升高而减小;由表中的数据知该反应随温度的升高而增大,可推知升高温度,平衡向正反应方向移动,所以该反应为吸热反应。把起始浓度代入平衡常数的表达式中,其比值小于800℃时的K值,则反映将向正反应方向移动,H2O的消耗速率比生成速率小;830℃时,平衡常数为,设反应中转化的CO2浓度为x,则反映过程中的物质浓度的变化情况为:CO2(g) + H2(g)
 CO(g) + H2O(g)
CO(g) + H2O(g)起始时(mol·L-1) 2 1 0 0
转化了(mol·L-1) x x x x
平衡时(mol·L-1) 2-x 1-x x x
依据平衡常数的关系可得:(2-x)(1-x)=x·x,解得x=2/3,则平衡后CO2的转化率为1/3,H2的转化率为2/3。

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
 ══
══
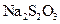

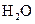
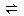 H2(g)+ CO2(g),在773K时,平衡常数Kc =" 9" ,如反应开始时CO和H2O的浓度都是0.020 mol/L ,计算在次条件下,CO的最大转化率是多少?
H2(g)+ CO2(g),在773K时,平衡常数Kc =" 9" ,如反应开始时CO和H2O的浓度都是0.020 mol/L ,计算在次条件下,CO的最大转化率是多少?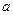 mol A和
mol A和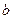 mol B在一个容积可变的容器中发生反应:A(g)+2B(g)
mol B在一个容积可变的容器中发生反应:A(g)+2B(g) 2C(g),一段时间后达到平衡,生成
2C(g),一段时间后达到平衡,生成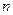 mol C。则下列说法中正确的是 ( )
mol C。则下列说法中正确的是 ( )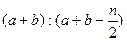
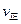 (A)=2
(A)=2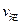 (B)时,可确定反应达平衡
(B)时,可确定反应达平衡