题目内容
【题目】某化学小组选用酸性高锰酸钾溶液和草酸溶液,探究外界条件对化学反应速率的影响,进行了如下了三组实验:[实验内容及记录]
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
mol/L H2C2O4溶液 | H2O | 0.05mol/L KMnO4溶液 | 3 mol/L稀硫酸 | ||
1 | 3.0 | 1.0 | 4.0 | 2.0 | 4.0 |
2 | 2.0 | 2.0 | 4.0 | 2.0 | 5.2 |
3 | 1.0 | 3.0 | 4.0 | 2.0 | 6.4 |
请回答:
(1)[实验原理] _________________________________________(写离子方程式)
(2)为完成实验目的,H2C2O4溶液的物质的量浓度不低于__________________
(3)根据上表中的实验数据,可以得到的结论是_______________________________
(4)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:v(KMnO4)=______ 。
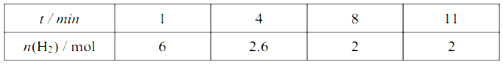
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设。并继续进行实验探究。
①该小组同学提出的假设是_________________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||||
_____mol/L H2C2O4溶液 | H2O | 0.05mol/L KMnO4溶液 | 3 mol/L稀硫酸 | |||||
4 | 3.0 | 1.0 | 4.0 | 2.0 | t | |||
③若该小组同学提出的假设成立,应观察到的现象是__________________________________
【答案】 2MnO4-+5H2C2O4+6H+=== 2Mn2++10CO2↑+8H2O 0.5mol/L 其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大 0.005mol / (L·min) 生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用) MnSO4 与实验1比较,溶液褪色所需时间短或所用时间(t)小于4.0min
【解析】(1)本题的实验原理是酸性高锰酸钾氧化草酸,酸性高锰酸钾褪色生成二价锰离子,草酸中的C被氧化为二氧化碳,化学方程式为:2KMNO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O,故答案为:2KMNO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O;
(2)高锰酸钾的物质的量为:0.05molL-1×0.004L=0.0002mol,根据方程式2KMNO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O,H2C2O4的物质的量至少为0.0002mol×![]() =0.0005mol,在实验③中要保证高锰酸钾完全反应,物质的量浓度至少为
=0.0005mol,在实验③中要保证高锰酸钾完全反应,物质的量浓度至少为![]() =0.5mol/L,故答案为:0.5mol/L;
=0.5mol/L,故答案为:0.5mol/L;
(3)从表中数据可知改变的条件是H2C2O4溶液的浓度;其他条件相同时,增大H2C2O4溶液的浓度,反应速率增大,故答案为:其他条件相同时,增大H2C2O4溶液的浓度,反应速率增大;
(4)实验1中,高锰酸钾的物质的量为:0.05molL-1×0.004L=0.0002mol,混合后高锰酸钾的物质的量浓度为![]() =0.02mol/L,因此v(KMnO4)=
=0.02mol/L,因此v(KMnO4)=![]() =0.005mol / (L·min) ,故答案为:0.005mol/(Lmin);
=0.005mol / (L·min) ,故答案为:0.005mol/(Lmin);
(5)①由图乙可知反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂,故答案为:生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用);
②与实验1作对比实验,则加入的硫酸锰的量不同,其它条件必须相同,所以加入的少量固体为MnSO4,故答案为:MnSO4;
③若该小组同学提出的假设成立,则反应速率加快,溶液褪色的时间小于4min,从而说明Mn2+是催化剂,故答案为:与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min)。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案【题目】2013年9月以来,我国很多地区再大面积出现雾霾,特别是华中华北尤其严重,汽车尾气、燃煤废气和冬季取暖排放的CO2等都是形成雾霾的原因。
Ⅰ.用于净化汽车尾气的反应为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H<0,在一定温度下,如图在一体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。
2CO2(g)+N2(g)△H<0,在一定温度下,如图在一体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。
(1)能判断该反应达到平衡状态的标志是_______。
A.在单位时间内生成1mol CO2的同时消耗了1mol CO
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.混合气体的压强不再变化
(2)在t2时刻将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件.请在图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:___________
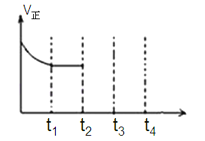
Ⅱ.使用石油热裂解的副产物CH4来制取H2,其生产流程如图1所示:
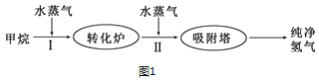
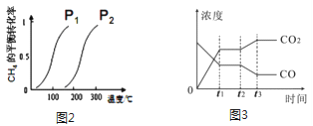
(3)此流程的第Ⅰ步反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g),一定条件下CH4的平均转化率与温度、压强的关系如图2所示,则P1_____P2(填“>”、“<”或“=”),100℃时,将1molCH4(g)和2molH2O(g)通入容积为100L的恒容的密闭容器中,达到平衡时CH4的转化率为0.5。此时该反应的平衡常数K____________ (写出完整的计算过程)
CO(g)+3H2(g),一定条件下CH4的平均转化率与温度、压强的关系如图2所示,则P1_____P2(填“>”、“<”或“=”),100℃时,将1molCH4(g)和2molH2O(g)通入容积为100L的恒容的密闭容器中,达到平衡时CH4的转化率为0.5。此时该反应的平衡常数K____________ (写出完整的计算过程)
(4)此流程的第Ⅱ步反应的平衡常数随温度的变化情况如下表
温度/℃ | 400 | 500 | 830 |
平衡常数K | 10 | 9 | 1 |
温度/℃ | 400 | 500 | 830 |
平衡常数K | 10 | 9 | 1 |
从表上可以推断该反应是___________(填“吸热”或“放热”)反应,若反应在500℃时进行,设CO(g)和H2O(g)的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时,CO的转化率为________;
(5)图3表反应Ⅱ在t1时达到平衡,在t2时因改变某个条件引起浓度变化的情况,图中t2时改变的条件是降低温度或________________(写一种)