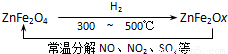
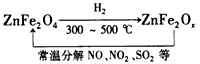题目内容
臭氧可使湿润的淀粉KI试纸变蓝,反应为:KI+O3+H2O→KOH+I2+O2(未配平).下列结论正确的是( )A.O3在反应中被氧化成O2
B.KI在反应中做氧化剂
C.1 mol O3反应中得到2 mol电子
D.反应中氧化产物O2与还原产物I2的物质的量之比为1:1
【答案】分析:该反应中碘元素化合价由-1价变为0价,氧元素的化合价由0价变为-2价,注意臭氧和氧气中化合价相同.
解答:解:A.臭氧和氧气的化合价都是0价,所以臭氧在反应中不被氧化,故A错误;
B.该反应中碘元素的化合价降低,所以碘化钾作还原剂,故B错误;
C.该反应中1molO3反应中得到1mol×(2-0)=2 mol电子,故C正确;
D.该反应中氧化产物是碘,还原产物是氢氧化钾,故D错误;
故选C.
点评:本题考查了氧化还原反应,明确元素化合价是解本题关键,难度不大.
解答:解:A.臭氧和氧气的化合价都是0价,所以臭氧在反应中不被氧化,故A错误;
B.该反应中碘元素的化合价降低,所以碘化钾作还原剂,故B错误;
C.该反应中1molO3反应中得到1mol×(2-0)=2 mol电子,故C正确;
D.该反应中氧化产物是碘,还原产物是氢氧化钾,故D错误;
故选C.
点评:本题考查了氧化还原反应,明确元素化合价是解本题关键,难度不大.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
 2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol
2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol