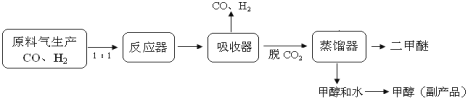
题目内容
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判断正确的是( )
A.生成42.0 L N2(标准状况) B.转移电子的物质的量为1.25 mol
C.有0.250 mol KNO3被氧化 D.被氧化的N原子的物质的量为3.75 mol
【答案】BD
【解析】
试题分析:10NaN3+2KN03→K20+5Na20+16N2↑中,N元素由+5价降低为0,反应中共转移10电子,若氧化产物比还原产物多1.75mol,由反应可知,生成16molN2时氧化产物比还原产物多14mol,则该反应生成氮气为![]() =2mol。A、生成标况下氮气的体积为2mol×22.4L/mol=44.8L,故A错误;B、转移电子的物质的量为0.25mol×(5-0)=1.25mol,故B正确;C、由反应可知,KN03被还原,被还原的硝酸钾的物质的量为2mol×
=2mol。A、生成标况下氮气的体积为2mol×22.4L/mol=44.8L,故A错误;B、转移电子的物质的量为0.25mol×(5-0)=1.25mol,故B正确;C、由反应可知,KN03被还原,被还原的硝酸钾的物质的量为2mol×![]() =0.25mol,故C错误;D、转移10mol电子被氧化的N原子为30mol,则转移1.25mol电子被氧化的N原子的物质的量为
=0.25mol,故C错误;D、转移10mol电子被氧化的N原子为30mol,则转移1.25mol电子被氧化的N原子的物质的量为![]() =3.75mol,故D正确;故选BD。
=3.75mol,故D正确;故选BD。

练习册系列答案
相关题目