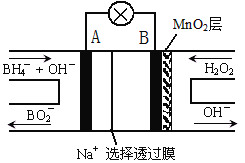
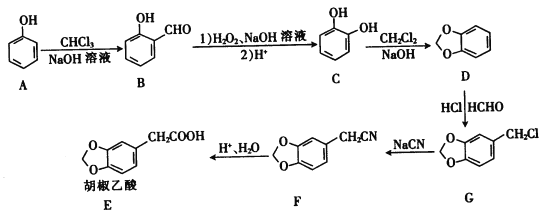
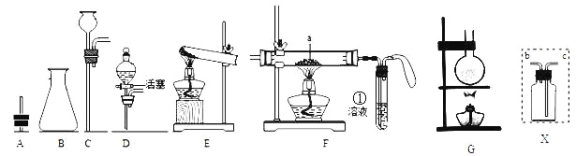
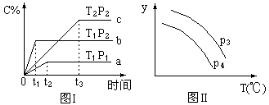
题目内容
【题目】(1)NaHCO3溶液中存在多种平衡关系,写出相应平衡关系所对应的离子方程式:_ _ 。
NaHCO3溶液显碱性的原因: _ 。
NaHSO4溶液显酸性的原因: 。
(2)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O。放出571.6kJ的热量,表示H2燃烧热的热化学方程式为____________ 。
(3)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为______________ _ 。
(4)已知C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol,
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ/mol,
C(s)+0.5O2(g)=CO(g) △H3=akJ/mol,则a=__________
(5)已知N2(g) +3H2(g) ![]() 2NH3(g)的平衡常数为K1,0.5 N2(g)+1.5H2(g)
2NH3(g)的平衡常数为K1,0.5 N2(g)+1.5H2(g) ![]() NH3(g) 的平衡常数为K2,NH3(g)
NH3(g) 的平衡常数为K2,NH3(g) ![]() 0.5 N2(g)+1.5H2(g) 的平衡常数为K3,写出K1和K2的关系式__________,写出K2和K3的关系式____________,写出K1和K3的关系式_____________
0.5 N2(g)+1.5H2(g) 的平衡常数为K3,写出K1和K2的关系式__________,写出K2和K3的关系式____________,写出K1和K3的关系式_____________
【答案】(1)H2O ![]() H++OH-;HCO3-+H2O
H++OH-;HCO3-+H2O ![]() OH-+H2CO3;HCO3-+H2O
OH-+H2CO3;HCO3-+H2O ![]() H3O++ CO32-;NaHCO3溶液中HCO3-的水解程度大于电离程度,使得溶液中c(OH-) 大于 c(H+)而显碱性;NaHSO4溶液中NaHSO4完全电离成Na+、H+、SO42-,使得溶液中c(H+)大于c(OH-)而显酸性;
H3O++ CO32-;NaHCO3溶液中HCO3-的水解程度大于电离程度,使得溶液中c(OH-) 大于 c(H+)而显碱性;NaHSO4溶液中NaHSO4完全电离成Na+、H+、SO42-,使得溶液中c(H+)大于c(OH-)而显酸性;
(2)H2(g)+![]() O2(g)=H2O(l)△H=-285.8KJ/mol;
O2(g)=H2O(l)△H=-285.8KJ/mol;
(3)NaOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(4)-110.5;
(5)K1=K22;K2· K3=1;K1· K32=1;
【解析】
试题分析:(1)NaHCO3溶液中存在水的电离,碳酸氢钠的电离和水解,对应的离子方程式为H2O ![]() H++OH-;HCO3-+H2O
H++OH-;HCO3-+H2O ![]() OH-+H2CO3;HCO3-+H2O
OH-+H2CO3;HCO3-+H2O ![]() H3O++ CO32-;NaHCO3的电离程度小于水解程度,导致溶液显碱性;硫酸是强酸,NaHSO4完全电离成Na+、H+、SO42-,使得溶液中c(H+)大于c(OH-)而显酸性,故答案为:H2O
H3O++ CO32-;NaHCO3的电离程度小于水解程度,导致溶液显碱性;硫酸是强酸,NaHSO4完全电离成Na+、H+、SO42-,使得溶液中c(H+)大于c(OH-)而显酸性,故答案为:H2O ![]() H++OH-;HCO3-+H2O
H++OH-;HCO3-+H2O ![]() OH-+H2CO3;HCO3-+H2O
OH-+H2CO3;HCO3-+H2O ![]() H3O++ CO32-;NaHCO3溶液中HCO3-的水解程度大于电离程度,使得溶液中c(OH-) 大于 c(H+)而显碱性;NaHSO4溶液中NaHSO4完全电离成Na+、H+、SO42-,使得溶液中c(H+)大于c(OH-)而显酸性;
H3O++ CO32-;NaHCO3溶液中HCO3-的水解程度大于电离程度,使得溶液中c(OH-) 大于 c(H+)而显碱性;NaHSO4溶液中NaHSO4完全电离成Na+、H+、SO42-,使得溶液中c(H+)大于c(OH-)而显酸性;
(2)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O,放出571.6kJ的热量,即2mol氢气完全燃烧放出571.6kJ的热量,则1mol氢气完全燃烧放出的燃量为285.8KJ,所以氢气的燃烧热为-285.8KJ/mol,氢气和氧气都是气态,水是液态,则氢气的燃烧热的热化学方程式为:H2(g)+![]() O2(g)=H2O(l)△H=-285.8KJ/mol;故答案为:H2(g)+
O2(g)=H2O(l)△H=-285.8KJ/mol;故答案为:H2(g)+![]() O2(g)=H2O(l)△H=-285.8KJ/mol;
O2(g)=H2O(l)△H=-285.8KJ/mol;
(3)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,中和热为-57.3kJ/mol,则中和热的热化学方程式:NaOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol,故答案为:NaOH(aq)+
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol,故答案为:NaOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(4)已知①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol,②2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ/mol,根据盖斯定律,将①-②×![]() 得:C(s)+0.5O2(g)=CO(g) △H3=(-393.5kJ/mol)-(-566.0kJ/mol)×
得:C(s)+0.5O2(g)=CO(g) △H3=(-393.5kJ/mol)-(-566.0kJ/mol)×![]() =-110.5kJ/mol,故答案为:-110.5;
=-110.5kJ/mol,故答案为:-110.5;
(5)0.5 N2(g)+1.5H2(g) ![]() NH3(g) 的平衡常数为K2,则 N2(g)+3H2(g)
NH3(g) 的平衡常数为K2,则 N2(g)+3H2(g) ![]() 2 NH3(g) 的平衡常数为K22,因此K1=K22;反应0.5 N2(g)+1.5H2(g)
2 NH3(g) 的平衡常数为K22,因此K1=K22;反应0.5 N2(g)+1.5H2(g) ![]() NH3(g)是NH3(g)
NH3(g)是NH3(g) ![]() 0.5 N2(g)+1.5H2(g)的逆反应,因此K2· K3=1,则K22· K32=1,因此K1· K32=1,故答案为:K1=K22;K2· K3=1;K1· K32=1;
0.5 N2(g)+1.5H2(g)的逆反应,因此K2· K3=1,则K22· K32=1,因此K1· K32=1,故答案为:K1=K22;K2· K3=1;K1· K32=1;

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案