题目内容
化学反应N2+3H2===2NH3的能量变化如右图所示,该反应的热化学方程式是
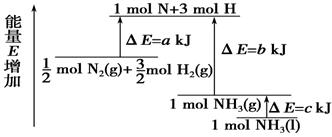
A.N2(g)+3H2(g)===2NH3(l) ΔH=2(a-b-c)kJ·mol-
B.N2(g)+3H2(g)===2NH3(g) ΔH=2(b-a)kJ·mol-1
C. 1/2 N2 (g)+3/2H2(g)===NH3(l) ΔH=(b+c-a)kJ·mol-1
D. 1/2 N2(g)+3/2H2(g)===NH3(g) ΔH=(a+b)kJ·mol-1
【答案】
A
【解析】根据图像可知,akJ是活化能。由于反应物的总能量高于生成物的总能量,所以是放热反应,方程式为1/2 N2(g)+3/2H2(g)===NH3(l) ΔH=(a-b)kJ·mol-1。如果生成气态氨气,则是1/2 N2(g)+3/2H2(g)===NH3(g) ΔH=(a-b-c)kJ·mol-1,所以正确的答案选A。

练习册系列答案
相关题目



 C、N2(g)+H2(g) = NH3(l) ⊿H = (b+c—a)kJ/mol
C、N2(g)+H2(g) = NH3(l) ⊿H = (b+c—a)kJ/mol  N2(g)+
H2(g) =NH3(g)
⊿H = (a+b)kJ/mol [来源:Z.xx.k.Com][来源:ZXXK]
N2(g)+
H2(g) =NH3(g)
⊿H = (a+b)kJ/mol [来源:Z.xx.k.Com][来源:ZXXK]