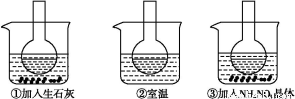
题目内容
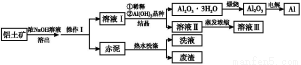
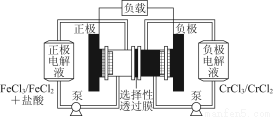
工业上常用Fe作电极电解处理含Cr2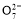 的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是( )
的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是( )
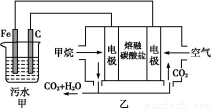
A.燃料电池中若有1.6 g CH4参加反应,则甲中C电极理论上生成气体体积为8.96 L
B.实验时若污水中离子浓度较小,导电能力较差,可加入适量的Na2SO4
C.该燃料电池正极的电极反应式为:O2+4e-+2CO2=2C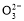
D.甲中阳极附近溶液中的离子反应方程式是:Cr2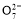 +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O
A
【解析】乙为原电池,作电源用,甲为电解池。乙中甲烷一极为负极,空气一极为正极,则甲中Fe为阳极,C为阴极,A项由于未指明标准状况,气体体积无法计算;由图中乙中正极进入的物质为空气和CO2,知此两者为反应物,则电极反应为:O2+4e-+2CO2=2C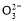 ,负极反应为:CH4-8e-+4C
,负极反应为:CH4-8e-+4C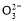 =5CO2+2H2O,C正确;B项,Na2SO4是电解质,可增强导电性,同时对污水中阴、阳离子的放电都没有影响,正确;甲中Fe溶解:Fe-2e-=Fe2+,生成的Fe2+具有还原性,所以将Cr2
=5CO2+2H2O,C正确;B项,Na2SO4是电解质,可增强导电性,同时对污水中阴、阳离子的放电都没有影响,正确;甲中Fe溶解:Fe-2e-=Fe2+,生成的Fe2+具有还原性,所以将Cr2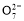 还原,依题干中信息知:该还原过程要消耗H+,形成Cr3+,进而形成Cr(OH)3沉淀,配平方程式即可,D正确。
还原,依题干中信息知:该还原过程要消耗H+,形成Cr3+,进而形成Cr(OH)3沉淀,配平方程式即可,D正确。

练习册系列答案
相关题目