题目内容
加兰他敏是目前用于治疗老年性痴呆的药物之一。下面是它的一种合成路线(Ph表示C6H5—):
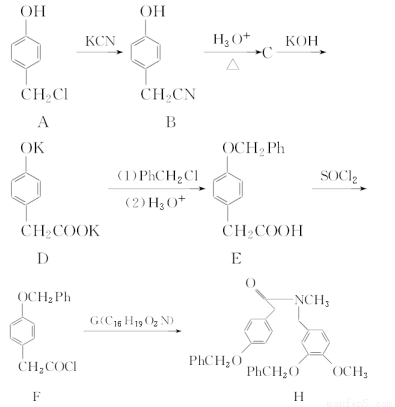
→……→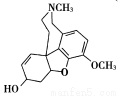
I(加兰他敏)
(1)化合物B的分子式是________。
(2)A→B的反应类型是________,A分子中含有的官能团为_____(填官能团名称)。
(3)G的结构简式是__________________。
(4)写出C与NaHCO3溶液反应的化学方程式为_________________。
(5)下列关于E的说法正确的是________。
a.能使酸性KMnO4溶液褪色
b.能与Na2CO3溶液反应
c.能与FeCl3溶液发生显色反应
d.1 mol E完全燃烧消耗17 mol O2
(1)C8H7ON
(2)取代反应 酚羟基、氯原子
(3)
(4)

(5)abd
【解析】(1)根据B的结构简式可知其分子式为C8H7ON。
(2)A→B的反应是—CN取代—Cl,A分子中含有的官能团为酚羟基和氯原子。(3)分析合成路线中F和H的结构简式,对比它们之间的异同,结合G的分子式,可推出G的结构简式为 。(4)根据B、C、D间的反应可推出C为
。(4)根据B、C、D间的反应可推出C为 ,酚羟基不与NaHCO3溶液反应,只考虑羧基与NaHCO3溶液反应。(5)E中与苯环相连的碳原子上有氢,该侧链可被酸性KMnO4溶液氧化;E分子中含羧基,故可与Na2CO3溶液反应;不含酚羟基,故不能与FeCl3溶液发生显色反应;E的分子式为C15H14O3,1 mol E完全燃烧消耗17 mol O2。
,酚羟基不与NaHCO3溶液反应,只考虑羧基与NaHCO3溶液反应。(5)E中与苯环相连的碳原子上有氢,该侧链可被酸性KMnO4溶液氧化;E分子中含羧基,故可与Na2CO3溶液反应;不含酚羟基,故不能与FeCl3溶液发生显色反应;E的分子式为C15H14O3,1 mol E完全燃烧消耗17 mol O2。

二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
(1)二氧化锰在酸性介质中是一种强氧化剂,请用化学方程式证明:______________________。
(2)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。
①电池工作时,MnO2发生________反应。
②电池的正极反应式为________。
(3)工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
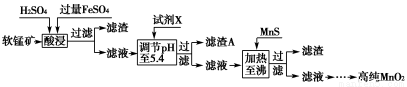
已知:软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表。
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 |
沉淀物 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
pH | 8.0 | -0.42 | 2.5 | 7 | 7 |
回答下列问题:
①硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为________________________。
②试剂X为________。
③滤渣A的主要成分为________。
④加入MnS的目的主要是除去溶液中的________。
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用如图所示装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如表所示。
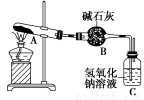
装置 | A(试管+粉末) | B | C |
反应前 | 42.0 g | 75.0 g | 140.0 g |
反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是( )
A.4CuSO4 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
B.3CuSO4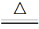 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑
C.5CuSO4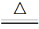 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑
D.6CuSO4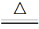 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑