题目内容
【题目】关于化学反应与能量的说法中错误的是( ) 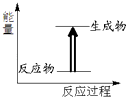
A.如图所示的反应为放热反应
B.化学反应中有物质变化也有能量变化
C.需要加热的化学反应不一定是吸热反应
D.化学键断裂吸收能量,化学键生成放出能量
【答案】A
【解析】解:A、反应物的总能量小于生成物的总能量为吸热反应,而不是放热反应,故A错误; B、有新物质生成的反应为化学反应,化学反应中化学键断裂吸收能量化学键生成放出能量,所以在生成新物质的同时还伴随能量的变化,故B正确;
C、有的放热反应也需要反应条件,如碳的燃烧是放热反应需要点燃或加热,所以需要加热的化学反应不一定是吸热反应,故C正确;
D、化学反应过程中,反应物的化学键断裂要吸收能量,形成新的化学键要放出能量,故D正确;
故选A.
A、反应物的总能量小于生成物的总能量为吸热反应;
B、化学反应在生成新物质的同时还伴随能量的变化;
C、有的放热反应也需要反应条件;
D、断裂键吸收能量,生成键放出能量.

【题目】金属钒及其化合物有着广泛的应用,现有如下回收利用含钒催化剂[含有V2O5、VOSO4(强电解质)及不溶性残渣]的工艺的主要流程:

部分含钒物质在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 | HVO3 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 | 难溶 |
请回答下列问题:
(1)工业上常用铝热反应由V2O5冶炼金属钒,化学方程式为__________。
(2)反应①、②、③、④中,发生氧化还原反应的是__________(填序号),写出反应①的离子方程式____。操作1、操作2用到的玻璃仪器是___________。
(3)反应③的沉淀率(又称沉钒率)是回收钒的关键之一,下图是反应温度与沉钒率的关系图,则控制温度的方法是_____________。

(4)反应④在焙烧过程中随温度的升高发生了两步反应。已知234gNH4VO3固体质量的减少值△W随温度(T)变化的曲线如图。试写出300℃~350℃时反应的化学方程式___________。
(5)全钒电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+![]() VO2++H2O+V3+。电池充电时阳极的电极反应式为____________。
VO2++H2O+V3+。电池充电时阳极的电极反应式为____________。
【题目】如图是煤化工产业链的一部分,试运用所学知识,解决下列问题: 
(1)已知该产业链中某反应的平衡表达式为:K= ![]() ,它所对应反应的化学方程式为;
,它所对应反应的化学方程式为;
(2)二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3 . 工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应: ①CO(g)+2H2(g)CH3OH(g)△H1=﹣90.7kJmol﹣1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=﹣23.5kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=﹣41.2kJmol﹣1
(i)催化反应室中总反应的热化学方程式为 , 830℃时反应③的K=1.0,则在催化反应室中反应③的K1.0(填“>”、“<”或“=”).
(ii)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2mol/L,a=mol/L.
(iii)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c/(molL﹣1) | 0.8 | 1.24 | 1.24 |
①此时刻,v正v逆(填“大于”、“小于”或“等于”).
②平衡时二甲醚的物质的量浓度是 .