题目内容
【题目】甲胺(CH3NH2) 的性质与氨相似。25℃时,向10mL1.0000mol·L-1甲胺溶液中滴入0.5000mol·L-1的稀硫酸,溶液的pOH 与所加稀硫酸的体积(V)关系如图所示。
已知:pOH=-lgc(OH-),Kb(CH3NH2·H2O)=4.0×10-4。下列说法正确的是( )
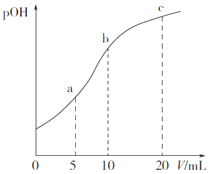
A. pOH=7 时,2c(CH3NH3+)=c(SO42-)
B. 水的电离程度:c>b>a
C. a点溶液中存在:c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-)
D. 25℃时1.000 mol·L-1甲胺溶液中CH3NH2·H2O的电离度约为2.0%
【答案】D
【解析】A. pOH=7时,溶液显中性,则根据电荷守恒可知c(CH3NH3+)=2c(SO42-),A错误;B. b点二者恰好反应,生成的盐水解促进水的电离,所以水的电离程度最大的是b点,B错误;C. a点硫酸不足,甲胺过量一半,溶液显碱性,溶液中存在:c(CH3NH3+)>c(CH3NH2·H2O)>c(OH-)>c(H+),C错误;D. 根据电离常数可知25℃时1.000mol·L-1甲胺溶液中氢氧根的浓度是0.02mol/L,则CH3NH2·H2O的电离度约为![]() =2.0%,D正确,答案选D。
=2.0%,D正确,答案选D。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】相关物质的溶度积常数见下表(25℃):
物质 | Mg(OH)2 | CH3COOAg | AgCl | Ag2CrO4 |
Ksp(单位略) | 1.1×10—11 | 2.3×10﹣3 | 1.8×10﹣10 | 1.9×10﹣12 |
下列有关说法中不正确的是
A. 浓度均为0.2 molL﹣1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀
B. 将0.001 molL﹣1的AgNO3溶液滴入0.001 molL﹣1的KCl和0.001 molL﹣1 的K2CrO4混合溶液中.先产生Ag2CrO4沉淀
C. 0.11 molL﹣1的MgCl2溶液中加入氨水产生Mg(OH)2沉淀时溶液的pH为9
D. 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变