题目内容
铜有+1价和+2价,铜及其合金在日常生活中应用广泛.根据下列信息回答相关问题.
(1)工业冶炼铜的原理主要是:
(Ⅰ)2Cu2S(硫化亚铜)+3O2![]() 2Cu2O+2SO2
2Cu2O+2SO2
(Ⅱ)2Cu2O(氧化亚铜)+Cu2S![]() 6Cu+SO2↑.
6Cu+SO2↑.
①关于氧化亚铜、硫化亚铜的判断,正确的是
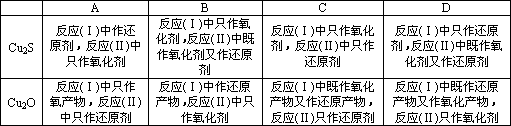
②如果反应(Ⅰ)和反应(Ⅱ)产生的二氧化硫质量相等,则转移的电子数之比为________
A.1∶1
B.2∶1
C.1∶2
D.3∶1
(2)西汉刘安在《淮南万毕术》中介绍了我国在西汉时期发明了湿法冶金技术,即“曾青得铁化为铜”,其含义是铜的可溶性化合物的水溶液与铁反应生成铜.例如,硫酸铜溶液与铁反应:CuSO4+Fe![]() Cu+FeSO4.下列有关该反应的判断:①属于置换反应;②铁被氧化;③铜是氧化产物;④氧化性:FeSO4>CuSO4;⑤还原性:Fe>Cu.其中不正确的是________.
Cu+FeSO4.下列有关该反应的判断:①属于置换反应;②铁被氧化;③铜是氧化产物;④氧化性:FeSO4>CuSO4;⑤还原性:Fe>Cu.其中不正确的是________.
A.①⑤
B.②③
C.③④
D.②⑤
(3)现代冶铜可以利用热还原法,如H2+CuO![]() Cu+H2O,2Al+3CuO
Cu+H2O,2Al+3CuO![]() 3Cu+Al2O3,CO+CuO
3Cu+Al2O3,CO+CuO![]() Cu+CO2.若制取等质量的还原产物,参加反应的还原剂H2、Al、CO的质量比为________.
Cu+CO2.若制取等质量的还原产物,参加反应的还原剂H2、Al、CO的质量比为________.
A.1∶1∶1
B.1∶3∶1
C.1∶9∶14
D.3∶2∶3
(4)铜器保存不善,在潮湿的空气中会生铜锈,主要的化学反应为2Cu+CO2+O2+H2O![]() Cu2(OH)2CO3(铜绿),该反应属于化合反应,判断的依据是________;该反应是氧化还原反应,判断的依据是________;氧化产物是________,还原产物是________,判断的依据分别是________.
Cu2(OH)2CO3(铜绿),该反应属于化合反应,判断的依据是________;该反应是氧化还原反应,判断的依据是________;氧化产物是________,还原产物是________,判断的依据分别是________.
解析:
答案:(1)①B ②A (2)C (3)C (4)反应物有四种,产物只有一种 铜元素的化合价升高,氧元素的化合价降低 Cu2(OH)2CO3 Cu2(OH)2CO3它既是铜被氧化的产物,也是氧气被还原的产物
讲析:本题以新闻信息为背景,以铜为主线,主要考查氧化还原反应及其概念的判断,从概念出发,由元素化合价的变化为切入点.(1)反应(Ⅰ)中,铜元素的化合价没有变(都是+1价),硫元素的化合价由-2升至+4,氧元素的化合价由0降至-2,SO2既是氧化产物又是还原产物,Cu2O是还原产物,转移的电子数为12e-;反应(Ⅱ)中Cu2O、Cu2S中+1价的铜都降至0价,硫元素的化合价由-2升至+4,所以,Cu2O是氧化剂,Cu2S既是氧化剂又是还原剂,转移的电子数为6e-.若生成等质量的SO2,转移的电子数之比为1∶1.(2)在CuSO4+Fe![]() Cu+FeSO4反应中,CuSO4是氧化剂,Fe是还原剂,Cu是还原产物,FeSO4是氧化产物.(3)根据反应式计算,若生成64 g Cu,参加反应的H2、Al、CO的质量依次为2 g、18 g、28 g.(4)分析反应2Cu+CO2+O2+H2O
Cu+FeSO4反应中,CuSO4是氧化剂,Fe是还原剂,Cu是还原产物,FeSO4是氧化产物.(3)根据反应式计算,若生成64 g Cu,参加反应的H2、Al、CO的质量依次为2 g、18 g、28 g.(4)分析反应2Cu+CO2+O2+H2O![]() Cu2(OH)2CO3,从产物种类看,该反应是化合反应;从元素化合价变化看,铜元素的化合价由0升至+2,氧元素的化合价由0降至-2,它是氧化还原反应.氧化剂得电子,化合价降低;还原剂失电子,化合价升高.氧化剂被还原,生成的是还原产物;还原剂被氧化,生成的是氧化产物.
Cu2(OH)2CO3,从产物种类看,该反应是化合反应;从元素化合价变化看,铜元素的化合价由0升至+2,氧元素的化合价由0降至-2,它是氧化还原反应.氧化剂得电子,化合价降低;还原剂失电子,化合价升高.氧化剂被还原,生成的是还原产物;还原剂被氧化,生成的是氧化产物.
点评:判断氧化还原反应中的概念,要熟记“升(化合价升高)、失(失去电子)、氧(被氧化)、还(还原剂)、氧(氧化产物),降(化合价降低)、得(得到电子)、还(被还原)、氧(氧化剂)、还(还原产物)”.根据金属活动性顺序,可以判断常见金属的活泼性(还原性)顺序和金属阳离子的氧化能力(铁对应的阳离子是Fe2+).


 Cu(OH)2+2H+
Cu(OH)2+2H+