题目内容
早在1807年化学家戴维用电解熔融氢氧化钠制得钠: 4NaOH(熔)  4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:
4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:
3Fe+4NaOH Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
| A.电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e→H2↑+O2↑ |
| B.盖·吕萨克法制钠原理是利用铁的还原性比钠强 |
| C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数相同 |
| D.目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阳极,铁为阴极 |
D
解析试题分析:A、由4NaOH(熔) 4Na+O2↑+2H2O可知,阳极氢氧根离子放电生成氧气和水,电极反应为4OH--4e-=2H2O+O2↑,故A错误;B、1100℃时生成Na蒸气,有利于反应正向移动,但Na的还原性大于Fe,故B错误;C、由4NaOH(熔)
4Na+O2↑+2H2O可知,阳极氢氧根离子放电生成氧气和水,电极反应为4OH--4e-=2H2O+O2↑,故A错误;B、1100℃时生成Na蒸气,有利于反应正向移动,但Na的还原性大于Fe,故B错误;C、由4NaOH(熔) 4Na+O2↑+2H2O、3Fe+4NaOH
4Na+O2↑+2H2O、3Fe+4NaOH Fe3O4+2H2↑十4Na↑可知,戴维法生成4molNa转移4mol电子,但盖?吕萨克法生成4molNa转移8mol电子,故转移电子不等,因此C错误;D、石墨极为阳极,氯离子放电,在阴极钠离子放电,发生反应2NaCl
Fe3O4+2H2↑十4Na↑可知,戴维法生成4molNa转移4mol电子,但盖?吕萨克法生成4molNa转移8mol电子,故转移电子不等,因此C错误;D、石墨极为阳极,氯离子放电,在阴极钠离子放电,发生反应2NaCl 2Na+Cl2↑,故D正确,答案选D。
2Na+Cl2↑,故D正确,答案选D。
考点:考查金属冶炼以及电解原理的有关判断

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案铅蓄电池的电池反应为 Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l),下列说法错误的是
2PbSO4(s)+2H2O(l),下列说法错误的是
| A.放电时覆盖PbO2的电极为正极,发生还原反应 |
| B.放电时电解质溶液中的H+向正极移动 |
| C.充电时阴极的电极反应为 PbSO4(s) + 2e-="Pb(s)" + SO42-(aq) |
| D.充电时电解质溶液的pH逐渐增大 |
用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是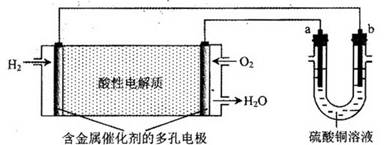
| A.燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH- |
| B.若a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.若a、b极都是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
| D.若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
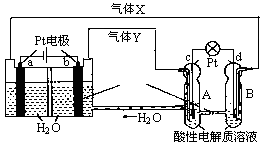
下图是酸性燃料电池酒精检测仪,两电极材料均为Pt。下列说法正确的是( )
| A.X极发生还原反应 |
| B.每生成0.6克CH3COOH,电子转移为0.04 mol |
| C.Y极反应方程式为:O2+4e-+2H2O=4OH— |
| D.质子移向X极 |
某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法不正确的是 
| A.工作时电极b作正极,O2-由电极b流向电极a |
| B.负极的电极反应式为:CO+O2- ―2e-=CO2 |
| C.当传感器中通过2×10-3mol电子时,说明通过的尾气中含有2. 24mL CO |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
按如图装置进行实验(N装置中两个电极均为石墨棒),下列描述正确的是( )
| A.a、b未连接时,装置N中C1电极上有气体析出 |
| B.不论a、b是否连接,装置M中观察到的实验现象相同 |
| C.a、b连接,工作一段时间后装置M中溶液pH变大,装置N中溶液pH变小 |
| D.a、b连接,装置M中若有0.1mol SO42-移到Cu电极,装置N中C2极放出 H22.24 L(标准状况) |
下图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是
| A.该装置将化学能转化为电能 |
| B.催化剂b表面O2发生还原反应,其附近酸性增强 |
| C.催化剂a表面的反应是:SO2+2H2O-2e- ═SO42-+4H+ |
| D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8: 15 |
|
Al-AgO 电池性能优越,可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,则下列说法正确的是
| A.AgO/Ag电极是负极 |
| B.当电极上析出1.08 g Ag时,电路中转移的电子为0.02mol |
| C.Al电极的反应式为:Al—3e-+4OH-= AlO2-+2H2O |
| D.在电解质溶液中OH-由Al电极移向AgO/Ag电极 |