题目内容
Al-AgO 电池性能优越,可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,则下列说法正确的是
| A.AgO/Ag电极是负极 |
| B.当电极上析出1.08 g Ag时,电路中转移的电子为0.02mol |
| C.Al电极的反应式为:Al—3e-+4OH-= AlO2-+2H2O |
| D.在电解质溶液中OH-由Al电极移向AgO/Ag电极 |
BC
解析试题分析:电池总反应中铝元素由0升为+3价,发生氧化反应,说明Al电极是负极,而银元素由+1降为0价,发生还原反应,说明AgO/Ag电极是正极,故A错误;由于n=m/M,则正极上析出的Ag为0.01mol,由于2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O~6e一中各物质的系数之比等于物质的量之比,则电路中转移电子的物质的量为Ag的两倍,即0.02mol,故B正确;由总反应推断,负极主要反应物→产物是Al→AlO2一;由于化合价升高总数等于失去电子数,则Al—3e一→AlO2一;由于NaOH是强碱,应选择OH一使左右电荷总数相等,则Al—3e一+4OH一→AlO2一;由于左边比右边多4个H、2个O,说明生成物还有水,则Al电极的反应式为Al—3e一+4OH一=AlO2一+2H2O,故C正确;OH一是带负电的阴离子,原电池内电路中阴离子移向负极,则OH一应由AgO/Ag电极移向Al电极,故D错误。
考点:本题考查新型电池,涉及正负极、氧化还原反应过程中转移电子、负极反应式、离子定向移动方向等。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案早在1807年化学家戴维用电解熔融氢氧化钠制得钠: 4NaOH(熔)  4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:
4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:
3Fe+4NaOH Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
| A.电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e→H2↑+O2↑ |
| B.盖·吕萨克法制钠原理是利用铁的还原性比钠强 |
| C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数相同 |
| D.目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阳极,铁为阴极 |
用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为 ( )
| A.1mol·L-1 | B.2 mol·L-1 | C.3 mol·L-1 | D.4 mol·L-1 |
根据图示判断下列叙述符合事实的是
| A.图①连接好并放置片刻后,铁片会镀上一层铜 |
| B.图②连接好导线后(片与片相接触),电流表会发生明显偏转 |
| C.图③连接好并放置片刻后,在Zn片附近加一滴酚酞溶液,溶液变为红色 |
| D.图④发生反应为Fe+2H+=Fe2++H2↑时,a、b可能是同种材料的电极 |
按下图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)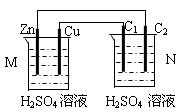
| A.C1上发生还原反应 |
| B.M 装置中SO42-移向Cu电极 |
| C.工作一段时间后装置M 中溶液pH变大,装置N中溶液pH变小 |
| D.Cu电极与C2电极上的电极反应相同 |
按下图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)
| A.C1上发生还原反应 |
| B.M 装置中SO42-移向Cu电极 |
| C.工作一段时间后装置M 中溶液pH变大,装置N中溶液pH变小 |
| D.Cu电极与C2电极上的电极反应相同 |
下列说法正确的是
| A.工业上用电解MgCl2溶液的方法制备金属Mg |
| B.在潮湿的空气中,生铁比纯铁更耐腐蚀 |
| C.向鸡蛋清中加入饱和的CuSO4或(NH4)2SO4溶液均产生沉淀,两者原理相同 |
| D.往沸水中滴入饱和的FeCl3溶液,继续煮沸至液体呈透明的红褐色,可制得Fe(OH)3胶体 |
中国在2009年推出了国产燃料电池概念汽车,该车装有“绿色心脏”——质子交换膜燃料电池.如图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )
| A.工作时“X极”周围溶液的酸性增强 |
| B.氢气在电极上发生还原反应 |
| C.图中标出的“Y极”实际是原电池的负极 |
| D.工作过程中,质子(H+)从“Y极”一边透过质子交换膜移动到“X极”一边与OH-反应生成水 |
燃料电池是利用燃料(如H2、CO、CH4等)跟氧气反应从而将化学能转化成电能的装置。下列关于甲烷燃料电池(NaOH溶液作电解质)的说法中正确的是
| A.负极反应为:O2+2H2O+ 4e-= 4OH- |
| B.负极反应为:CH4+ 10OH-- 8e-= CO32- + 7H2O |
| C.放电时正极发生氧化反应,外电路中电子从正极流向负极 |
| D.随着放电的进行,溶液的pH保持不变 |