题目内容
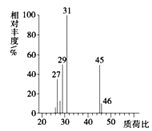
【题目】常温下,取浓度均为0.1mol/L的HX溶液和ROH溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol·L-1盐酸进行滴定。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法正确的是
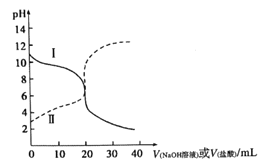
A. HX为强酸,ROH为弱碱
B. 滴定前,ROH溶液中存在c(ROH)>c(OH-)>c(R+)>c(H+)
C. 曲线Ⅱ:滴定至V=10mL时存在2c(OH-)-c(H+)=c(HX)-c(X-)
D. 滴定至V=40mL的过程中,两种溶液中由水电离出的c(H+)·c(OH-)不变
【答案】B
【解析】常温下,0.1mol/L的HX溶液的PH=3,0.1mol/L的ROH溶液PH=11,所以HX为弱酸、ROH为弱碱,故A错误;根据电荷守恒,滴定前,ROH溶液中存在c(ROH)>c(OH-)>c(R+)>c(H+),故B正确;曲线Ⅱ是用氢氧化钠溶于滴定HX,滴定至V=10mL时,溶质是等浓度的HX、NaX,根据物料守恒和电荷守恒,存在2c(OH-)-2c(H+)=c(HX)-c(X-),故C错误;滴定至V=40mL的过程中盐酸、氢氧化钠均过量,两种溶液中由水电离出的c(H+)·c(OH-)先增大后减小,故D错误。

练习册系列答案
相关题目
【题目】用图中所示装置进行实验,实验现象与预测不一致的是( )
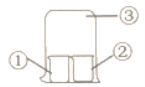
①中的物质 | ②中的物质 | 预测现象 | |
A | 饱和亚硫酸 | 蓝色石蕊试液 | ②中溶液先变红色又褪色 |
B | 饱和氯水 | 湿润红纸条 | ②中红纸条褪色 |
C | 浓双氧水 | H2S溶液 | ②中有淡黄色沉淀 |
D | 浓氨水 | 浓盐酸 | ③中有白烟 |
A. A B. B C. C D. D