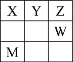题目内容
【题目】根据下列表格,回答有关问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
一 | ||||||||
二 | a | b | c | d | ||||
三 | e | f | g | h | i | j | k | l |
(1)上表中,a元素的元素符号为____,第一电离能最小的元素是____(填元素名称,下同),电负性最大的元素是___。
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是____(填化学式,下同),碱性最强的是_____。
(3)某元素最高价氧化物对应的水化物呈两性,则该元素是/span>_____(填对应的字母),该元素与c元素形成的化合物能否与NaOH溶液反应(若能,写出相应的离子方程式;若不能,则填“否”)_______。
(4)在e~k元素的原子中,原子半径最小的是_____(填元素符号),其价电子排布式为_________;未成对电子数最多的是____(填元素符号),其最高价氧化物对应水化物的化学式为_____;有两个未成对电子的元素是____(填元素符号);M层有两个空轨道的是____(填元素符号),其阳离子结构示意图为____。
【答案】C 钠 氟 HClO4 NaOH g Al2O3+2OH-=2AlO2- +H2O Cl 3s23p5 P H3PO4 Si、S Al ![]()
【解析】
由元素在周期表中的位置,可确定:a、b、c、d、e、f、g、h、i、j、k、l分别为碳(C)、氮(N)、氧(O)、氟(F)、钠(Na)、镁(Mg)、铝(Al)、硅(Si)、磷(P)、硫(S)、氯(Cl)、氩(Ar)。
(1)上表中,a元素的元素符号为C;同周期从左到右元素的第一电离能呈增大趋势,同主族从上到下元素的第一电离能逐渐减小,则第一电离能最小的元素是钠;同周期从左到右元素的电负性逐渐增大,同主族从上到下元素的电负性逐渐减小,电负性最大的元素是氟。答案为:C;钠;氟;
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是氯元素形成的高氯酸,其化学式为HClO4;钠的金属性最强,其最高价氧化物对应水化物的碱性最强,其化学式是NaOH。答案为:HClO4;NaOH;
(3)某元素最高价氧化物对应的水化物呈两性,则该元素是铝,对应的字母为g;该元素与氧(O)元素形成的化合物为Al2O3,氧化铝属于两性氧化物,能与NaOH溶液反应,离子方程式为Al2O3+2OH-=2AlO2- +H2O。答案为:g;Al2O3+2OH-=2AlO2- +H2O;
(4)同周期元素,从左往右,原子半径依次减小,在e~k元素的原子中,原子半径最小的是Cl,其价电子排布式为3s23p5;未成对电子数最多的是价电子排布式为3s23p3的磷,其元素符号为P,其最高价氧化物对应水化物的化学式为H3PO4;有两个未成对电子的元素其价电子排布可能是3s23p2、3s23p4,它们是Si、S;M层有两个空轨道的元素,其价电子排布式为3s23p1,其元素符号是Al,其阳离子结构示意图为![]() 。答案为:Cl;3s23p5;P;H3PO4;Si、S;Al;
。答案为:Cl;3s23p5;P;H3PO4;Si、S;Al;![]() 。
。

【题目】某化学兴趣小组对加碘食盐中碘酸钾进行研究,查阅资料得知:碘酸钾是一种白色粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂与HI、H2O2等物质作用,被还原为单质碘。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
①称取wg加碘盐,加适量蒸馏水溶解。
②用稀硫酸酸化所得的溶液,再加入过量KI溶液,写出该步反应的离子方程式:_______。
③以淀粉为指示剂,用物质的量浓度为1.00×10-3molL-1的Na2S2O3溶液滴定![]() 滴定时的反应方程式为
滴定时的反应方程式为![]() ,滴定时Na2S2O3溶液应放在 ______
,滴定时Na2S2O3溶液应放在 ______ ![]() 填“酸式滴定管”或“碱式滴定管”
填“酸式滴定管”或“碱式滴定管”![]() ,滴定至终点的现象为_______________。
,滴定至终点的现象为_______________。
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
顺序 | 步骤 | 实验现象 |
① | 取少量纯净的NaCl,加适量蒸馏水溶解 | 溶液无变化 |
② | 滴入少量淀粉-KI溶液,振荡 | 溶液无变化 |
③ | 然后再滴加稀硫酸,振荡 | 溶液变蓝色 |
请推测实验③中产生蓝色现象的可能原因: __________________ ;根据学生乙的实验结果可推测学生甲的实验结果可能 ______ (填“偏大”、“偏小”或“无影响”)。
(3)学生丙设计实验证明加碘食盐样品中碘元素的存在形式是IO3-而不是I-,进行如下实验。写出实验步骤、预期现象和结论。限选试剂:稀硫酸、稀硝酸、3% H2O2溶液、新制氯水、1%淀粉溶液、蒸馏水。
实验步骤 | 预期现象和结论 |
步骤1:取少量食盐样品于试管中,加适量蒸馏水使其完全溶解, _____________________ | ______ |
步骤2:另取少量食盐样品于试管中,加适量蒸馏水使其完全溶解,滴入适量的稀硫酸酸化, _____________________ | ______ |