��Ŀ����
��10�֣��о�̼���仯��������öԴٽ���̼���Ĺ���������Ҫ�����塣ijѧϰС��������ϲ��������̽�������æ�������̽����
��1��pC������pH����ָ��ϡ��Һ�е�����Ũ�ȵij��ö����ĸ�ֵ����ij��Һ��ij���ʵ�Ũ��Ϊ1��10��3 mol/L�������Һ�и����ʵ�pC����lg(1��10��3)��3����ͼΪ25��ʱH2CO3��Һ��pC��pHͼ����ش��������⣺��������Ũ��С��10-5mol/L������Ϊ�����Ӳ����ڣ�

����ͬһ��Һ�У�H2CO3��HCO3����CO32��________(��ܡ����ܡ�)�������档
��H2CO3һ������ƽ�ⳣ������ֵKa1 ��
��
������ѪҺ����Ҫͨ��̼�����λ�����ϵ(H2CO3/HCO3��)���Ե����������ά��pH 7.4���������������ѪҺ��ʱ��ѪҺ������ϵ�е�c(H+)/c(H2CO3)���ս� ��
7.4���������������ѪҺ��ʱ��ѪҺ������ϵ�е�c(H+)/c(H2CO3)���ս� ��
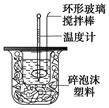
��2������ʱ����CO��ԭMgSO4���Ʊ��ߴ�MgO����MgO���Ƴɡ�þ���������Ρ�ȼ�ϵ�أ���װ��ʾ��ͼ��ͼ��
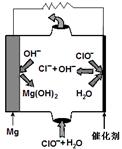
�õ�ط�Ӧ�����ӷ���ʽΪ ��
��3��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ�� CO2(g) +3H2(g) CH3OH(g) +H2O(g) ��H ��
CH3OH(g) +H2O(g) ��H ��
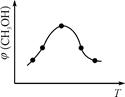
��ȡ��ݵ����CO2��H2�Ļ������(���ʵ���֮�Ⱦ�Ϊ1��3)���ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ������ͼ
��ʾ��������CO2ת��Ϊ�״���Ӧ�Ȧ�H 0(�>�� ��<������)��
��һ���¶��£����ݻ���ͬ�ҹ̶��������ܱ������У������·�ʽͶ�뷴Ӧ�һ��ʱ���ﵽƽ�⡣
������ƽ��������ѹǿΪ��ʼʱ��0.8����Ҫʹƽ���������и�����Ũ����ͬ������ʼʱά�ַ�Ӧ������У���c��ȡֵ��ΧΪ ��
��1��pC������pH����ָ��ϡ��Һ�е�����Ũ�ȵij��ö����ĸ�ֵ����ij��Һ��ij���ʵ�Ũ��Ϊ1��10��3 mol/L�������Һ�и����ʵ�pC����lg(1��10��3)��3����ͼΪ25��ʱH2CO3��Һ��pC��pHͼ����ش��������⣺��������Ũ��С��10-5mol/L������Ϊ�����Ӳ����ڣ�

����ͬһ��Һ�У�H2CO3��HCO3����CO32��________(��ܡ����ܡ�)�������档
��H2CO3һ������ƽ�ⳣ������ֵKa1
 ��
��������ѪҺ����Ҫͨ��̼�����λ�����ϵ(H2CO3/HCO3��)���Ե����������ά��pH
 7.4���������������ѪҺ��ʱ��ѪҺ������ϵ�е�c(H+)/c(H2CO3)���ս� ��
7.4���������������ѪҺ��ʱ��ѪҺ������ϵ�е�c(H+)/c(H2CO3)���ս� ��| A����� | B����С | C���������� | D�����ж� |

�õ�ط�Ӧ�����ӷ���ʽΪ ��
��3��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ�� CO2(g) +3H2(g)
 CH3OH(g) +H2O(g) ��H ��
CH3OH(g) +H2O(g) ��H ����ȡ��ݵ����CO2��H2�Ļ������(���ʵ���֮�Ⱦ�Ϊ1��3)���ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ������ͼ
��ʾ��������CO2ת��Ϊ�״���Ӧ�Ȧ�H 0(�>�� ��<������)��

��һ���¶��£����ݻ���ͬ�ҹ̶��������ܱ������У������·�ʽͶ�뷴Ӧ�һ��ʱ���ﵽƽ�⡣
| �� �� | �� | �� |
| ��Ӧ�� Ͷ���� | 1molCO2 3molH2 | a molCO2��b molH2�� c molCH3OH(g)��c molH2O(g) |
����10�֣�
��1���ٲ��� (1��) ��10-6�� (2��) ��A��(1��)
��2��Mg + ClO- + H2O = Cl- + Mg(OH)2��2�֣���
��3���٣� (2��) �� 0.4��c��1 ��2�֣���
��1���ٲ��� (1��) ��10-6�� (2��) ��A��(1��)
��2��Mg + ClO- + H2O = Cl- + Mg(OH)2��2�֣���
��3���٣� (2��) �� 0.4��c��1 ��2�֣���
�����������1���٣�H2CO3�ᷢ�������H+�� HCO3���ᷢ�������H+�ͷ���ˮ����H+�� CO32���ᷢ��ˮ����H+��ϣ���H2CO3��HCO3����CO32�����ܴ������档�ڷ���ͼ�п��Կ�����PH=6ʱH2CO3����һ�����룬���Ka1
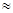 10-6���۹������Ậ�д�����H+�����c(H+)/c(H2CO3)���ս����
10-6���۹������Ậ�д�����H+�����c(H+)/c(H2CO3)���ս������2����ͼ�з����ó���Mg�Ǹ�����ʧȥ���ӣ�����Mg(OH)2��ClO-��õ���������Cl-����˵�ط�Ӧ�����ӷ���ʽΪ��Mg + ClO- + H2O = Cl- + Mg(OH)2��
��3������ͼ��֪��ߵ㷴Ӧ����ƽ�⣬��ƽ����¶�Խ�ߣ��գ�CH3OH��ԽС��ƽ�����淴Ӧ���У������¶�ƽ�����ȷ�����У��淴ӦΪ���ȷ�Ӧ��������ӦΪ���ȷ�Ӧ������H3��0��
�ʴ�Ϊ������
�ڸ��ݷ�����ѧ����ʽ����Ӧǰ��Ļ�ѧ�����ʵ���֮����2:1������Ϊ����ƽ��������ѹǿΪ��ʼʱ��0.8�������c����С��Ϊ0.8/[��1mol+3mol��/2]=0.4mol,���ֵΪ1mol����c��ȡֵ��ΧΪ��0.4��c��1��
��������1�����⿼�����������ˮ��Һ�еĵ��뼰ͼ��ѧ������ȷ������ͼ���������ǽ����Ĺؼ�����ע������ϰ���е���Ϣ������ѶȲ���2������Ӷ���ǶȶԻ�ʯȼ�Ͻ�����ȫ��Ŀ��飬�Ѷ��еȣ�������ѧ�����������������������

��ϰ��ϵ�д�
�����Ŀ


 �������װ�øĽ��Ĵ�ʩ�����ɣ�
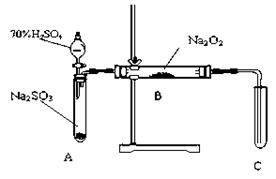
�������װ�øĽ��Ĵ�ʩ�����ɣ�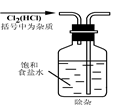 B
B  C
C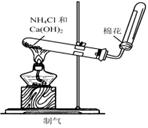 D��
D��