题目内容
pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是

- A.A是强酸,B是弱酸
- B.稀释后,A酸溶液的酸性比B酸溶液弱
- C.稀释后,A、B两种酸溶液的物质的量浓度: C(A)<C(B)
- D.稀释前,A、B两种酸溶液的物质的量浓度:C(A)=C(B)
D
试题分析:图中曲线A比B变化得快,而且最后A的PH值比B的大,所以A的酸性比B的强。但是两条都是曲线变化,不是直线变化,所以A、B都不是强酸。A、B选项错误。稀释后A的酸性比B强,电离程度比B大,所以C(A)>C(B),D选项由于一开始两个的PH值相等,所以算溶液的物质的量浓度相等。
考点:弱酸电离
点评:本题结合图像分析,难度不大,关键在于理解掌握。
试题分析:图中曲线A比B变化得快,而且最后A的PH值比B的大,所以A的酸性比B的强。但是两条都是曲线变化,不是直线变化,所以A、B都不是强酸。A、B选项错误。稀释后A的酸性比B强,电离程度比B大,所以C(A)>C(B),D选项由于一开始两个的PH值相等,所以算溶液的物质的量浓度相等。
考点:弱酸电离
点评:本题结合图像分析,难度不大,关键在于理解掌握。

练习册系列答案
相关题目
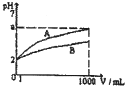 pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )