题目内容
下列有关实验操作,现象和结论都正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将过量CO2通入CaCl2溶液中 | 无白色沉淀 | 生成Ca(HCO3)2溶于水 |
| B | 常温下将Al片插入浓硫酸中 | 无明显现象 | Al片和浓硫酸不反应 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | 将SO2通入溴水中 | 溶液褪色 | SO2具有漂白性 |
C
试题分析:A、碳酸的酸性弱于盐酸,因此二氧化碳与氯化钙溶液不反应,A不正确;B、常温下将Al片插入浓硫酸中发生钝化,钝化是化学变化,B不正确;C、氨水显碱性,因此用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝色,C增强;D、SO2具有还原性,能被溴水氧化二使溴水褪色,D不正确,答案选D。

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目


 I2+5SO42—+H2O
I2+5SO42—+H2O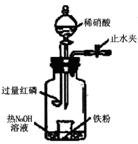
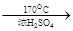 CH2=CH2↑+H2O。
CH2=CH2↑+H2O。