题目内容
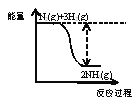
【题目】硫化钠在无机制备、废水处理等领域常用作沉淀剂,其水溶液称为“臭碱”。可在特殊条件下以硫酸钠固体与炭粉为原料制备:Na2SO4+2C![]() Na2S+2CO2↑
Na2S+2CO2↑

(1)硫化钠固体在保存时需注意________,原因是________。
(2)实验室用上图装置以Na2SO4与炭粉为原料制备Na2S并检验气体产物、进行尾气处理。步骤如下:
①连接仪器顺序为________(按气流方向,用小写字母表示);
②检查装置气密性;③________;
④加热,进行实验。
(3)若 a mol Na2SO4和2 a mol C按上述步骤充分反应,实际得到Na2S小于amol,则实验改进方案是________。
某同学从氧化还原角度分析固体产物中可能含有少量Na2SO3,请设计实验证明其猜测是否合理(供选择的试剂有:酚酞溶液、硝酸、稀盐酸、蒸馏水) ________。
(4)经实验测定,硫酸钠与炭粉在一定条件下反应还可生成等物质的量的两种盐和体积比为1︰3的CO2和CO两种气体。反应方程式为________。
【答案】密封 硫化钠容易被空气中的氧气氧化 abcefd 装入药品 增加碳的量 在试管中加入少量固体产物样品,加入蒸馏水溶解,再加入盐酸,看是否产生浑浊,如果产生淡黄色浑浊,则猜测合理,反之,不合理 2Na2SO4+4C![]() Na2S+ Na2SO3+CO2↑+3CO↑
Na2S+ Na2SO3+CO2↑+3CO↑
【解析】
(1)硫化钠中的S元素为S的最低价态,容易被氧化,据此分析判断;
(2)Na2SO4+2C![]() Na2S+2CO2↑,生成的硫化钠容易吸收水蒸气发生水解反应,从而与二氧化碳反应放出硫化氢气体,影响二氧化碳的检验,因此需要防止水蒸气进入反应装置,反应中可能生成一氧化碳,一氧化碳会污染空气,据此分析解答;
Na2S+2CO2↑,生成的硫化钠容易吸收水蒸气发生水解反应,从而与二氧化碳反应放出硫化氢气体,影响二氧化碳的检验,因此需要防止水蒸气进入反应装置,反应中可能生成一氧化碳,一氧化碳会污染空气,据此分析解答;
(3)反应过程中碳会与生成的二氧化碳在加热时反应生成一氧化碳;Na2SO3和Na2S在酸性溶液中反应生成硫,据此分析解答;
(4)硫酸钠与炭粉在一定条件下反应还可生成等物质的量的两种盐为硫化钠和亚硫酸钠和体积比为1︰3的CO2和CO两种气体,据此书写方程式。
(1)硫化钠中的S元素为S的最低价态,容易被氧化,在保存时需注意密封保存,故答案为:密封;硫化钠容易被空气中的氧气氧化;
(2)①Na2SO4+2C![]() Na2S+2CO2↑,生成的硫化钠容易吸收水蒸气发生水解反应,从而与二氧化碳反应放出硫化氢气体,影响二氧化碳的检验,因此需要防止水蒸气进入反应装置,反应中可能生成一氧化碳,一氧化碳会污染空气,需要防止污染,仪器的连接顺序为abcefd;连接好仪器后,首先检查装置气密性,装入药品,加热,开始实验,故答案为:abcefd;装入药品;
Na2S+2CO2↑,生成的硫化钠容易吸收水蒸气发生水解反应,从而与二氧化碳反应放出硫化氢气体,影响二氧化碳的检验,因此需要防止水蒸气进入反应装置,反应中可能生成一氧化碳,一氧化碳会污染空气,需要防止污染,仪器的连接顺序为abcefd;连接好仪器后,首先检查装置气密性,装入药品,加热,开始实验,故答案为:abcefd;装入药品;
(3)a mol Na2SO4和2 a mol C充分反应,反应过程中碳会与生成的二氧化碳在加热时反应生成一氧化碳,使得生成的Na2S小于amol,为了避免碳不足,需要增加碳的量;Na2SO3和Na2S在酸性溶液中反应生成淡黄色沉淀,因此实验方法为:在试管中加入少量固体产物样品,加入蒸馏水溶解,再加入盐酸,如果产生淡黄色浑浊,则猜测合理,反之,不合理,故答案为:增加碳的量;在试管中加入少量固体产物样品,加入蒸馏水溶解,再加入盐酸,如果产生淡黄色浑浊,则猜测合理,反之,不合理;
(4)硫酸钠与炭粉在一定条件下反应还可生成等物质的量的两种盐为硫化钠和亚硫酸钠和体积比为1︰3的CO2和CO两种气体,反应的化学方程式为2Na2SO4+4C![]() Na2S+ Na2SO3+CO2↑+3CO↑,故答案为:2Na2SO4+4C
Na2S+ Na2SO3+CO2↑+3CO↑,故答案为:2Na2SO4+4C![]() Na2S+ Na2SO3+CO2↑+3CO↑。
Na2S+ Na2SO3+CO2↑+3CO↑。