题目内容
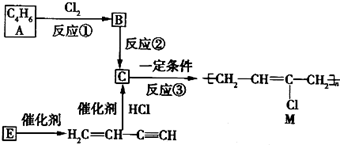
(10分) 已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
请回答下列问题:
(1)B、D分子中的官能团名称分别是__________、__________。
(2)写出下列反应的化学方程式,并注明反应类型:
②____________________,___________;④____________________,___________。
(3)在实验室利用B和D制备E的实验中,若用1mol B和1 mol D充分反应,能否生成1mol E_________,原因是__________。
(4)若184gB和120gD反应能生成106gE,则该反应的产率______________________。
(1)羟基、羧基(2)②2CH3CH2OH+O2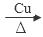 2CH3CHO+2H2O 氧化反应
2CH3CHO+2H2O 氧化反应
④CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O 取代反应(酯化反应)
CH3COOCH2CH3+H2O 取代反应(酯化反应)
(3)不能。该反应为可逆反应,有一定的限度,不可能完全转化
(4)60.2%
解析试题分析:由于A的产量通常用来衡量一个国家的石油化工水平,所以A是乙烯C2H4;乙烯与水发生加成反应产生B:乙醇CH3CH2OH;乙醇催化氧化得到C:乙醛CH3CHO;乙醛催化氧化得到D:乙酸CH3COOH;乙醇与乙酸在浓硫酸作用下发生酯化反应得到E:乙酸乙酯CH3COOCH2CH3和水。(1)B、D分子中的官能团名称分别是羟基、羧基;(2)②反应的化学方程式是2CH3CH2OH+O2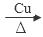 2CH3CHO+2H2O,反应类型是氧化反应;④反应的化学方程式是CH3COOH+CH3CH2OH
2CH3CHO+2H2O,反应类型是氧化反应;④反应的化学方程式是CH3COOH+CH3CH2OH  CH3COOCH2CH3+H2O ,反应类型是取代反应(也叫酯化反应);(3)由于酯化反应与酯的水解反应互为可逆反应,所以在实验室利用B和D制备E的实验中,若用1mol B和1 mol D充分反应,不能生成1mol E。(4)184g乙醇的物质的量是184g÷46g/mol="4mol;" 120g乙酸的物质的量是120g÷60g/mol=2mol,由于乙醇过量所以反应产生的乙酸乙酯应该按照乙酸来计算,理论上应该产生乙酸乙酯的质量是2mol×88g/mol=196g.实际反应能生成106gE,则该反应的产率(106g÷17 6g)×100%=60.2%。
CH3COOCH2CH3+H2O ,反应类型是取代反应(也叫酯化反应);(3)由于酯化反应与酯的水解反应互为可逆反应,所以在实验室利用B和D制备E的实验中,若用1mol B和1 mol D充分反应,不能生成1mol E。(4)184g乙醇的物质的量是184g÷46g/mol="4mol;" 120g乙酸的物质的量是120g÷60g/mol=2mol,由于乙醇过量所以反应产生的乙酸乙酯应该按照乙酸来计算,理论上应该产生乙酸乙酯的质量是2mol×88g/mol=196g.实际反应能生成106gE,则该反应的产率(106g÷17 6g)×100%=60.2%。
考点:考查有机物的性质、转化、方程式的书写、反应类型的判断及物质产率的计算的知识。

某有机物H3C—CH=CH—COOH,不能发生的反应类型
| A.氧化反应 | B.加成反应 | C.酯化反应 | D.水解反应 |
化合物G是一种医药中间体,常用于制备抗凝血药。可以通过下图所示的路线合成:
已知:RCOOH RCOCl;D与FeCl3溶液能发生显色。
RCOCl;D与FeCl3溶液能发生显色。
请回答下列问题:
(1)B→C的转化所加的试剂可能是_______________,CH3COCl+E→F的反应类型是_______________。
(2)有关G的下列说法正确的是________。
| A.属于芳香烃 |
| B.能与FeCl3溶液发生显色反应 |
| C.可以发生水解、加成、氧化、酯化等反应 |
| D.1mol G最多可以跟4mol H2反应 |
(4)F与足量NaOH溶液充分反应的化学方程式为______________________________。
(5)写出同时满足下列条件的E的同分异构体的结构简式____________________。
①能发生水解反应②与FeCl3溶液能发生显色反应③苯环上有两种不同化学环境的氢原子
(6)已知:工业上以氯苯水解制取苯酚,而酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯(
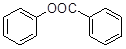 )是一种重要的有机合成中间体。试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。
)是一种重要的有机合成中间体。试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。注:合成路线的书写格式参照如下示例流程图:
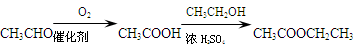
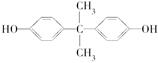 )。聚碳酸酯不耐高温,100 ℃时释放出的双酚A是25 ℃时的50倍。双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病。请回答下列问题:
)。聚碳酸酯不耐高温,100 ℃时释放出的双酚A是25 ℃时的50倍。双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病。请回答下列问题:


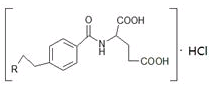 (不考虑立体结构,其中R为
(不考虑立体结构,其中R为 )。M的一条合成路线如下(部分反应试剂和条件略去)。
)。M的一条合成路线如下(部分反应试剂和条件略去)。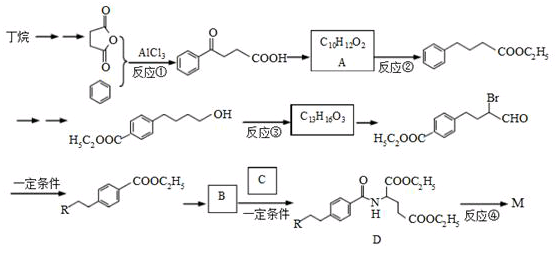
 B……
B……