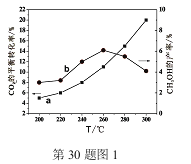
��Ŀ����
����Ŀ��Ŀǰ��ҵ�Ͽ���CO2������ȼ�ϼ״����йط�ӦΪ��
CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g�� ��H����49.0 kJ��mol��1���������Ϊ1L���ܱ������У�����1molCO2��3molH2����Ӧ�����в��CO2��CH3OH��g����Ũ����ʱ��ı仯��ͼ��ʾ��
CH3OH��g��+H2O��g�� ��H����49.0 kJ��mol��1���������Ϊ1L���ܱ������У�����1molCO2��3molH2����Ӧ�����в��CO2��CH3OH��g����Ũ����ʱ��ı仯��ͼ��ʾ��
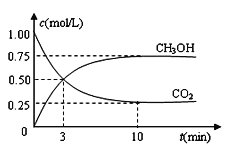
��1���ӷ�Ӧ��ʼ��ƽ�⣬������ƽ��Ũ��ΪC��H2����_____________��
��2�����ı�����ʹƽ��������Ӧ�����ƶ�����ƽ�ⳣ��______________���������
a�����ܲ��� b�����ܼ�С c���������� d�����䡢��С��������п���
��3���ܹ�˵���÷�Ӧ�Ѵﵽƽ�����__________������ĸ���,��ͬ����
A.���¡�����ʱ,�����ڵ�ѹǿ���ٱ仯
B.���¡�����ʱ,�����ڻ��������ܶȲ��ٱ仯
C.һ��������,CO2��H2��CH3OH��Ũ�ȱ��ֲ���
D.һ��������,��λʱ��������3molH2��ͬʱ����1mol CH3OH
��4���������������������£�����ϵ���ѹ����ԭ���Ķ���֮һ�������йظ���ϵ��˵����ȷ����________��
a��������Ũ�ȼ�С b������Ӧ���������淴Ӧ����Ҳ����
c���״������ʵ������� d������ƽ��ʱn��H2��/n��CH3OH������
��5������¶���T���¸÷�Ӧ��ƽ�ⳣ��K= ________������ʼʱ���1L�ܱ������г���1mol CO2,2mol H2,1.5mol CH3OH��1mol H2O��g��,��Ӧ��________����������������������Ӧ������С�
���𰸡���1��0.75mol��L��1��2��ac��3��AC��4��bc��5��16/3��
��������
�����������1����ͼ��֪��10min����ƽ�⣬ƽ��ʱ�״���Ũ�ȱ仯Ϊ0.75mol/L���ɷ���ʽCO2��g��+3H2��g��CH3OH��g��+H2O��֪��������Ũ�ȱ仯���ڼ״���Ũ�ȱ仯��Ϊ0.75mol/L��3=2.25mol/L����������ƽ��Ũ��ΪC��H2����3mol/1L-2.25mol/L=0.75mol/L��
��2����ѧƽ�ⳣ��ֻ���¶��йأ������ı��¶ȣ�ʹƽ�������ƶ�ʱ����ѧƽ�ⳣ�����䣬����Ӧ���ȣ��������¶�ʹƽ�������ƶ�ʱ����ѧƽ�ⳣ����С���ʴ�Ϊac��
��3��A.���巴Ӧ��������������ϵ���Ͳ��ȣ������¡�����ʱ,�����ڵ�ѹǿ���ٱ仯��˵����Ӧ�ﵽƽ��״̬����A��ȷ��B.��Ӧ��ϵ��Ϊ��̬�����������غ㶨�ɣ����¡�����ʱ,�����ڻ��������ܶ�ʼ�ձ��ֲ��䣬��һ����ƽ��״̬����B����C.һ��������,CO2��H2��CH3OH��Ũ�ȱ��ֲ���˵����Ӧ�ﵽƽ�⣬��C��ȷ��D.һ��������,��λʱ��������3molH2��ͬʱ����1molCH3OH������ʾ����Ӧ���ʣ����жϷ�Ӧ�ﵽƽ��״̬����D����ΪAC��
��4���������������������£�����ϵ���ѹ����ԭ���Ķ���֮һ����ʱ�����ʵ�Ũ��˲������һ����ƽ�����������ƶ�����Ӧ���Ũ�Ȼ����м�С���������Ũ�Ȼ��������a��������Ũ������a����b����������Ӧ������������b��ȷ�� c��ƽ�������ƶ����״������ʵ�����������c��ȷ��d��ƽ�������ƶ���n��H2����С��n��CH3OH����������ƽ��ʱn��H2��/n��CH3OH����С����d����Ϊbc��
��5��ƽ��ʱ�״�Ϊ0.75mol/L��������̼Ϊ0.25mol/L��H2Ϊ0.75mol/L��ˮҲΪ0.75mol/L����ƽ�ⳣ��K=![]() =16/3������ʼʱ���1L�ܱ������г���1mol CO2,2mol H2,1.5mol CH3OH��1mol H2O��g��,��ʱQ=
=16/3������ʼʱ���1L�ܱ������г���1mol CO2,2mol H2,1.5mol CH3OH��1mol H2O��g��,��ʱQ=![]() =��1.5��1��/��1��23��=3/16<K��˵����Ӧ������С�
=��1.5��1��/��1��23��=3/16<K��˵����Ӧ������С�

����Ŀ���Ե���̼���仯������о�������Ҫ���塣
��1������(N2H4��Ϊȼ�ϣ������������������������߷�Ӧ���ɵ�������̬ˮ��
��֪��N2(g��+2O2(g��=N2O4(g����H1K1
N2H4(g��+O2(g��=N2(g��2H2O(g����H2K2
��2N2H4(g��+ N2O4(g��=3N2(g��+ 4H2O(g�� ��H�� (����H1����H2��ʾ�����÷�Ӧ�Ļ�ѧƽ�ⳣ��K = (��K1��K2��ʾ��
��2������β��ת����Ӧ��NO��CO��N2��CO2(δ��ƽ��,��NO��COת��Ϊ��N2��CO2��ʵ�ֳ��ۣ�ÿ����1molN2��ԭ��ʧȥ������Ϊ ��
��3�� ������Ⱦ�ﵪ����������û���̿��ԭ��������ij�о�С����ij2L���ܱ������м���һ�����Ļ���̿��NO��������ӦC(s����2NO(g�� ![]() N2(g����CO2 (g������T1��ʱ����Ӧ���е���ͬʱ��(t����ø����ʵ����ʵ���(n������
N2(g����CO2 (g������T1��ʱ����Ӧ���е���ͬʱ��(t����ø����ʵ����ʵ���(n������
t(min�� n(mol�� | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 2.00 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
0~10min�ڣ�NO��ƽ����Ӧ����v(NO��= ��T1��ʱ���÷�Ӧ��ƽ������K= ��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬�����ϱ��������жϸı������������ (����ĸ�������
a������һ�����Ļ���̿ b��ͨ��һ������NO
c������ʱ������һ�����ĺ��� d�����������Ĵ���
��4����ȼ�ϵ��ʹ�õĵ������Һ��2mol��L-1��KOH��Һ����ط�ӦΪ��4NH3+3O2=2N2+6H2O���ŵ�ʱ���õ�������ĵ缫��ӦʽΪ ��
��5��������Ϊ�жϷ�Ӧ�ﵽ��ѧƽ��״̬�������� (����ĸ�������
A��������CO2��Ũ�ȱ��ֲ���
B��v��(N2��=2v��(NO��
C��������ѹǿ���ֲ���
D�����������ܶȱ��ֲ���
E����������ƽ����Է����������ֲ���