题目内容
【题目】ⅡBⅥA族半导体纳米材料(如CdTe、CdSe、ZnSe、ZnS等)在光电子器件、太阳能电池以及生物探针等方面有广阔的前景。回答下列问题:
(1)基态锌(Zn)原子的电子排布式为[Ar]_____。
(2)“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是______(填标号)
a 构造原理 b 泡利原理 c 洪特规则 d 能量最低原理
(3)在周期表中,Se与As、Br同周期相邻,与S、Te同主族相邻。Te、As、Se、Br的第一电离能由大到小排序为_______。
(4)H2O2和H2S的相对分子质量相等,常温下,H2O2呈液态,而H2S呈气态,其主要原因是______;![]() 的中心原子杂化类型为_______,其空间构型为_______。
的中心原子杂化类型为_______,其空间构型为_______。
(5)ZnO具有独特的电学及光学特性,是一种应用广泛的功能材料。
①已知锌元素、氧元素的电负性分别为1.65、3.5,ZnO中化学键的类型为______。ZnO可以被NaOH溶液溶解生成[Zn(OH)4]2—,请从化学键角度解释能够形成该离子的原因。_______。

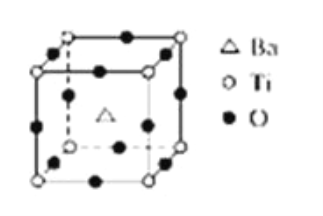
②一种ZnO晶体的晶胞如图所示。晶胞边长为a nm、阿伏加德罗常数的值为NA,其晶体密度为________g·cm3。
【答案】3d104s2 b Br>As>Se>Te H2O2分子间存在氢键 sp3杂化 三角锥形 离子键 Zn2+可以通过配位键与OH—结合成为络离子 3.24×1023/(a 3NA)
【解析】
(1)锌为30号元素,据此书写基态锌(Zn)原子的电子排布式;
(2)根据“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,结合各选项分析判断;
(3) 同周期元素,从左到右,元素的第一电离能呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素;同族元素,从上至下第一电离能逐渐减小,据此判断Te、As、Se、Br的第一电离能的大小顺序;
(4) H2O2分子间存在氢键,而H2S分子间不能形成氢键;根据价层电子对数=σ键个数+孤电子对个数分析解答;
(5)①根据电负性的差值>1.7,形成离子键,<1.7形成共价键判断;根据[Zn(OH)4]2—中存在配位键分析解答;②根据均摊法计算ZnO晶胞中含有的Zn、O原子数,计算晶胞的质量,再计算晶胞的密度。
(1)锌为30号元素,基态锌(Zn)原子的价电子排布式为 3d104s2,故答案为:3d104s2;
(2)“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是泡利原理,故答案为:b;
(3) 同周期元素,从左到右,元素的第一电离能呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素;同族元素,从上至下第一电离能逐渐减小。在周期表中,Se与As、Br同周期相邻,与S、Te同主族相邻,则Te、As、Se、Br的第一电离能由大到小排序为Br>As>Se>Te,故答案为:Br>As>Se>Te;
(4)H2O2和H2S的相对分子质量相等,但H2O2分子间存在氢键,沸点较高,H2S分子间不能形成氢键,使得常温下,H2O2呈液态,而H2S呈气态;![]() 的中心原子Se的价层电子对数=3+
的中心原子Se的价层电子对数=3+![]() =4,采用sp3杂化,其空间构型为三角锥形,故答案为:H2O2分子间存在氢键;sp3杂化;三角锥形;
=4,采用sp3杂化,其空间构型为三角锥形,故答案为:H2O2分子间存在氢键;sp3杂化;三角锥形;
(5)①锌元素、氧元素的电负性分别为1.65、3.5,ZnO中电负性的差值=3.5-1.65=1.85>1.7,构成离子键;Zn2+可以通过配位键与OH—结合成为络离子,导致ZnO可以被NaOH溶液溶解生成[Zn(OH)4]2—,故答案为:离子键;Zn2+可以通过配位键与OH—结合成为络离子;
②ZnO晶胞中含有Zn原子数=8×![]() +6×
+6×![]() =4,O原子数=12×
=4,O原子数=12×![]() +1=4,因此晶胞的质量=
+1=4,因此晶胞的质量=![]() g,晶胞的体积=(a×10-7)3cm3,晶胞的密度=
g,晶胞的体积=(a×10-7)3cm3,晶胞的密度=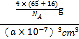 =
=![]() ×1023 g·cm3,故答案为:
×1023 g·cm3,故答案为:![]() ×1023。
×1023。

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案【题目】短同期主族元素![]() 原子序数依次增大。由这些元素组成的化合物甲、乙、丙、丁的
原子序数依次增大。由这些元素组成的化合物甲、乙、丙、丁的![]() 水溶液
水溶液![]() 如表,丙、丁为二元化合物。甲溶液逐滴滴入丙溶液中,先产生白色沉淀,后沉淀消失;乙的水溶液可除油污。下列说法一定正确的是
如表,丙、丁为二元化合物。甲溶液逐滴滴入丙溶液中,先产生白色沉淀,后沉淀消失;乙的水溶液可除油污。下列说法一定正确的是
| 甲 | 乙 | 丙 | 丁 |
| 13 | 11 | 5 | 1 |
A. 原子半径:![]() B. 配制丙溶液时需加入丁溶液
B. 配制丙溶液时需加入丁溶液
C. 乙溶液去油污时只涉及到盐类的水解D. 海水提镁的过程中一定用到化合物甲