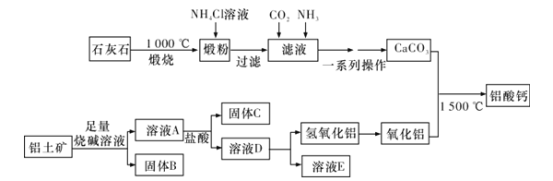
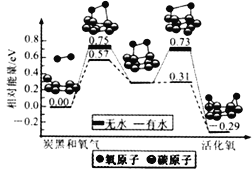
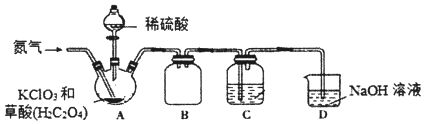
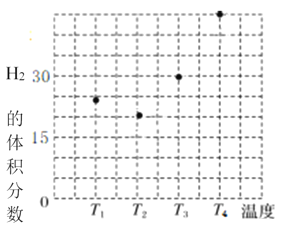
题目内容
【题目】以下是中学化学常见的四个装置,下列关于这些装置说法正确的是
A.装置在使用过程中,电池内部电子从Ag2O 极通过隔板移向锌粉
B.装置在使用过程中,电池外壳会逐渐变薄,容易出现漏液
C.装置在使用过程中,电解质溶液的 pH 不会发生变化
D.装置在使用过程中,阳极可以一直使用,不需要更换
【答案】B
【解析】
A. 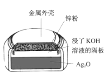 装置在使用过程中,锌为负极,因此电池内部电子从锌通过隔板移向Ag2O极,故A错误;
装置在使用过程中,锌为负极,因此电池内部电子从锌通过隔板移向Ag2O极,故A错误;
B.  装置在使用过程中,锌作负极,不断反应,因此电池外壳会逐渐变薄,容易出现漏液,故B正确;
装置在使用过程中,锌作负极,不断反应,因此电池外壳会逐渐变薄,容易出现漏液,故B正确;
C. 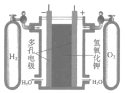 装置在使用过程中,反应生成了水,电解质KOH溶液浓度降低,碱性减弱,pH变小,故C错误;
装置在使用过程中,反应生成了水,电解质KOH溶液浓度降低,碱性减弱,pH变小,故C错误;
D. 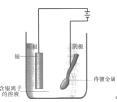 装置在使用过程中,阳极再不断消耗,需要定期更换,故D错误。
装置在使用过程中,阳极再不断消耗,需要定期更换,故D错误。
综上所述,答案为B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目