题目内容
【题目】已知A、B、C、D四种短周期元素的核电荷数依次增大.A原子s轨道电子数是p轨道电子数的两倍,C原子的L能层中有两对成对电子,C、D同主族. E、F是第四周期元素,且E位于周期表中ds区,F原子核外有33种不同运动状态的电子.根据以上信息用相应的元素符号填空:
(1)E+核外电子排布式为 , FC43﹣离子的空间构型为 , 与其互为等电子体的一种有机分子为(填化学式).
(2)B元素所在周期第一电离能最大的元素是(填元素符号).
(3)D所在周期元素最高价氧化物对应的水化物中,酸性最强的是(填化学式);能导电的A单质与B、D、E的单质形成的晶体相比较,熔点由高到低的排列顺序是(填化学式).
(4)已知EDC4溶液中滴入氨基乙酸钠(H2N﹣CH2﹣COONa)即可得到配合物A.其结构如图所示: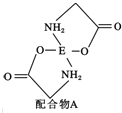
①配合物A中碳原子的轨道杂化类型为 .
②1mol氨基乙酸钠(H2N﹣CH2﹣COONa)含有σ键的数目为 .
(5)化合物F2C3常用于标定未知浓度的酸性KMnO4溶液,反应生成F的最高价含氧酸,该反应的离子方程式是 .
【答案】
(1)1s22s22p63s23p63d10;正四面体;CCl4
(2)Ne
(3)HClO4;C>Cu>S>N2
(4)sp3、sp2;8×6.02×1023
(5)5As2O3+4MnO ![]() +9H2O+12H+═10H3AsO4+4Mn2+
+9H2O+12H+═10H3AsO4+4Mn2+
【解析】解:A、B、C、D四种短周期元素的核电荷数依次增大,A原子s轨道电子数是p轨道电子数的两倍,原子核外电子排布为1s22s22p2 , 则A为碳元素;C原子的L能层中有两对成对电子,原子核外电子排布式为1s22s22p4 , 则C为O元素;B的原子序数介于碳、氧之间,则B为N元素;C、D同主族,则D为S元素; E、F是第四周期元素,且E位于周期表中ds区,结合(1)可以形成E+ , 则E为Cu;F原子核外有33种不同运动状态的电子,则F为As.(1)Cu+核外电子排布式为1s22s22p63s23p63d10 , AsO43﹣离子中As原子孤电子对数= ![]() =0,价层电子对数4+0=4,故为正四面体构型,与其互为等电子体的一种有机分子为CCl4 , 所以答案是:1s22s22p63s23p63d10;正四面体;CCl4;(2)N元素所在周期第一电离能最大的元素是Ne,所以答案是:Ne;(3)S所在周期元素最高价氧化物对应的水化物中,酸性最强的是HClO4;能导电的A单质为石墨,属于混合晶体,沸点很高,氮气常温下为气体,硫为分子晶体,沸点比较低,Cu为金属晶体,沸点比硫单质高,熔点由高到低的排列顺序是C>Cu>S>N2 , 所以答案是:HClO4;C>Cu>S>N2;(4)①亚甲基中C原子形成4个σ键、C=O中C原子形成3个σ键,均没有孤对电子,碳原子的轨道杂化类型为sp3、sp2 , 所以答案是:sp3、sp2 ;②1mol氨基乙酸钠(H2N﹣CH2﹣COONa)含有8molσ键,即含有8×6.02×1023个σ键,
=0,价层电子对数4+0=4,故为正四面体构型,与其互为等电子体的一种有机分子为CCl4 , 所以答案是:1s22s22p63s23p63d10;正四面体;CCl4;(2)N元素所在周期第一电离能最大的元素是Ne,所以答案是:Ne;(3)S所在周期元素最高价氧化物对应的水化物中,酸性最强的是HClO4;能导电的A单质为石墨,属于混合晶体,沸点很高,氮气常温下为气体,硫为分子晶体,沸点比较低,Cu为金属晶体,沸点比硫单质高,熔点由高到低的排列顺序是C>Cu>S>N2 , 所以答案是:HClO4;C>Cu>S>N2;(4)①亚甲基中C原子形成4个σ键、C=O中C原子形成3个σ键,均没有孤对电子,碳原子的轨道杂化类型为sp3、sp2 , 所以答案是:sp3、sp2 ;②1mol氨基乙酸钠(H2N﹣CH2﹣COONa)含有8molσ键,即含有8×6.02×1023个σ键,
所以答案是:8×6.02×1023;(5)化合物As2O3常用于标定未知浓度的酸性KMnO4溶液,反应生成H3AsO4 , 该反应的离子方程式是:5As2O3+4MnO4﹣+9H2O+12H+═10H3AsO4+4Mn2+ ,
所以答案是:5As2O3+4MnO4﹣+9H2O+12H+═10H3AsO4+4Mn2+ .
