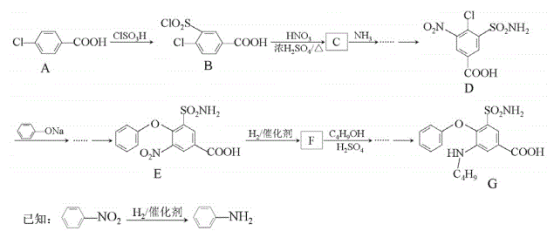
题目内容
【题目】化学家在氨的合成及利用氨制硝酸等方面做出了突出贡献。回答下列问题:
(1)N2和H2合成氨的化学方程式为___;为了降低能耗并提高原料利用率,科学家利用电解原理(两极间可传输![]() ),探索用N2和H2制备NH3,预测阴极的反应式为___。
),探索用N2和H2制备NH3,预测阴极的反应式为___。
(2)制备硝酸主要有三步转化过程:
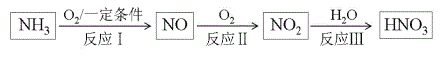
反应I的转化利用了NH3的__性,每生成1molNO转移电子数为___NA。
反应Ⅲ:3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g) ΔH<0,下列措施不能提高NO2吸收率的是__(填写选项字母)。
2HNO3(aq)+NO(g) ΔH<0,下列措施不能提高NO2吸收率的是__(填写选项字母)。
a.增大压强 b.降低温度 c.使用催化剂
(3)硝酸工业的尾气成分主要是NOx,通常利用NH3处理,将其转化为无毒物质后排放,该反应的化学方程式为___。
【答案】![]()
![]() 还原性 5 c
还原性 5 c ![]()
【解析】
(1)N2和H2在高温高压和催化剂存在的条件下生成氨气;电解池阴极得电子发生还原反应;
(2)反应I氮元素化合价由-3升高为+2;要提高NO2吸收率,应使3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g)平衡正向移动;
2HNO3(aq)+NO(g)平衡正向移动;
(3)NOx和NH3反应生成氮气和水,根据得失电子守恒配平方程式。
(1)N2和H2合成氨的化学方程式为![]() ;合成氨反应,氮元素化合价由0降低为-3,电解池阴极得电子发生还原反应,预测阴极的反应式为
;合成氨反应,氮元素化合价由0降低为-3,电解池阴极得电子发生还原反应,预测阴极的反应式为![]() ;
;
(2)反应I氮元素化合价由-3升高为+2,氨气是还原剂,表现还原性,每生成1molNO转移电子数为5NA;
a、3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g),正反应气体系数和减小,增大压强,平衡正向移动,能提高NO2吸收率,故不选a;
2HNO3(aq)+NO(g),正反应气体系数和减小,增大压强,平衡正向移动,能提高NO2吸收率,故不选a;
b. 3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g),正反应放热,降低温度,平衡正向移动,能提高NO2吸收率,故不选b;
2HNO3(aq)+NO(g),正反应放热,降低温度,平衡正向移动,能提高NO2吸收率,故不选b;
c.使用催化剂,能提高反应速率,但平衡不移动,不能提高NO2吸收率,故选c;
(3)NOx和NH3反应生成氮气和水,反应方程式是![]() 。
。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案【题目】X、Y是同周期的两种主族元素,他们的逐级电离能(I)数据如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 | I5 | …… |
X | 496 | 4562 | 6912 | 9543 | 13353 | …… |
Y | 738 | 1451 | 7733 | 10540 | 13630 | …… |
下到有关说法正确的是( )
A.电负性:X<YB.与水反应剧烈程度:X<Y
C.X的最外层电子数为1D.Y的最高化合价为+3