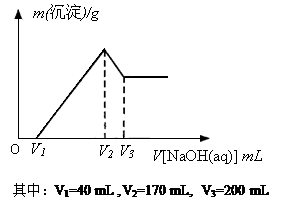
题目内容
(1)当x=0.8 时,溶液中产生的沉淀是什么?其物质的量为多少?
(2) 当沉淀只有 Fe(OH)3 时,计算x的取值范围.
(3)请在图中画出沉淀总量 n/mol 随 x (0~1)变化的曲线
⑴ Fe(OH)3 0.02 mol Al(OH)3 0.02 mol
⑵ 0<x≤0.6
⑶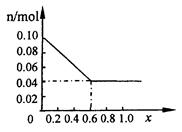
⑵ 0<x≤0.6
⑶

本题是混合物的综合计算题,为难题。
⑴Fe3++3OH-= Fe(OH)3↓①Al3++3OH-= Al(OH)3↓②Al(OH)3+OH-=AlO2-+2H2O ③ OH-适量时,Al3+、Fe3+生成沉淀,当OH-过量时,Al(OH)3溶解,生成AlO2-。 n(OH-)=0.09L×4mol/L="0.36mol," OH-对于两种离子生成沉淀是过量的,肯定可以使Al(OH)3溶解一些或全部,剩余OH-能使0.06mol Al(OH)3溶解.当x=0.8时,发生①、②两反应共消耗OH-0.30mol,生成Al(OH)3的物质的量为0.08mol,Fe(OH)3的物质的量为0.02mol,而剩余OH-0.06mol,此时Al(OH)3溶解0.06mol。因此,沉淀Fe(OH)3物质的量为0.02mol和Al(OH)3为0.02mol。
⑵溶液中无Al(OH)3,耗OH-0.1×4x,有:3×0.1(1-x)+0.4x=0.36,得x=0.6,所以当0<x≤0.6时,沉淀只有Fe(OH)3。
⑶当x∈(0,0.6)时,y=0.1(1-x)当x∈(0.6,1)时,①、②共生成沉淀0.1mol,剩余0.06molOH-,可使0.06molAl(OH)3溶解,此时沉淀的物质的量为:y="0.1" mol -0.06 mol =0.04mol。在图上作出即可。
⑴Fe3++3OH-= Fe(OH)3↓①Al3++3OH-= Al(OH)3↓②Al(OH)3+OH-=AlO2-+2H2O ③ OH-适量时,Al3+、Fe3+生成沉淀,当OH-过量时,Al(OH)3溶解,生成AlO2-。 n(OH-)=0.09L×4mol/L="0.36mol," OH-对于两种离子生成沉淀是过量的,肯定可以使Al(OH)3溶解一些或全部,剩余OH-能使0.06mol Al(OH)3溶解.当x=0.8时,发生①、②两反应共消耗OH-0.30mol,生成Al(OH)3的物质的量为0.08mol,Fe(OH)3的物质的量为0.02mol,而剩余OH-0.06mol,此时Al(OH)3溶解0.06mol。因此,沉淀Fe(OH)3物质的量为0.02mol和Al(OH)3为0.02mol。
⑵溶液中无Al(OH)3,耗OH-0.1×4x,有:3×0.1(1-x)+0.4x=0.36,得x=0.6,所以当0<x≤0.6时,沉淀只有Fe(OH)3。
⑶当x∈(0,0.6)时,y=0.1(1-x)当x∈(0.6,1)时,①、②共生成沉淀0.1mol,剩余0.06molOH-,可使0.06molAl(OH)3溶解,此时沉淀的物质的量为:y="0.1" mol -0.06 mol =0.04mol。在图上作出即可。

练习册系列答案
相关题目

 ,向含a mol KAl(SO4)2的溶液中,逐滴加入Ba(OH)2溶液,过程中可能存在以下多个离子方程式
,向含a mol KAl(SO4)2的溶液中,逐滴加入Ba(OH)2溶液,过程中可能存在以下多个离子方程式
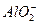 +2H2O
+2H2O