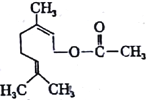
��Ŀ����
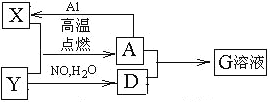
����Ŀ��ͼ��X��YΪ���ʣ�����Ϊ���������֮���������ת����ϵ�����ֲ�������ȥ�������У�A�׳ƴ�����������
�ش��������⣺
��1��NaOH�д��ڵĻ�ѧ��������Ϊ_____________��
��2��д��Y![]() D �Ļ�ѧ����ʽ��________________��
D �Ļ�ѧ����ʽ��________________��
��3��д��A��D��ϡ��Һ��Ӧ����G�����ӷ���ʽ��________________��
��4����4mol D��ϡ��Һ�У�����X��ĩ���������������ɵ�����ֻ��һ�֣���������ϵ�л���n(X2+)��n(X)�仯��ʾ��ͼ�������n(X2+)�����ֵ_______��
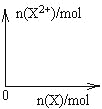
���𰸡� ���Ӽ������Թ��ۼ� 4NO + 3O2 + 2H2O = 4HNO3 3Fe3O4+28H��+NO3��![]() 9Fe3��+NO��+14H2O
9Fe3��+NO��+14H2O 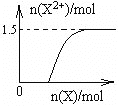
��������A�׳ƴ�������������AΪFe3O4����Al�������ȷ�Ӧ�����������͵�������X��YΪ���ʣ���XΪFe������������Ӧ����Fe3O4����YΪO2��DΪHNO3��G��ҺΪFe(NO3)3��Һ��
��1��. NaOH��������������������֮��������Ӽ�����ԭ������ԭ��֮����ڼ��Թ��ۼ����ʴ�Ϊ���Ӽ������Թ��ۼ���
��2��. NO��O2��ˮ��Ӧ����HNO3����ѧ����ʽΪ��4NO + 3O2 + 2H2O = 4HNO3���ʴ�Ϊ4NO + 3O2 + 2H2O = 4HNO3��
��3��. ���������������ᷴӦʱ����Ԫ�ر�������+3�ۣ������е�Ԫ�ر���ԭ��+2�ۣ����ݵ�ʧ�����غ��ԭ���غ�����ӷ���ʽΪ��3Fe3O4+28H��+NO3��![]() 9Fe3��+NO��+14H2O���ʴ�Ϊ��3Fe3O4+28H��+NO3��
9Fe3��+NO��+14H2O���ʴ�Ϊ��3Fe3O4+28H��+NO3��![]() 9Fe3��+NO��+14H2O��
9Fe3��+NO��+14H2O��
��4��.�����������ᷴӦ��ʵ�ʣ���ʼʱ��ȫ������������Ϊ���������ʿ�ʼ��Fe2+����Ϊ0���������ļ��룬��������ֺ�Fe3+��Ӧ����Fe2+����Fe2+������������ֱ���ﵽ���ֵ��Ȼ���ٱ仯����Ӧ���������ɵ�����ΪNO����Fe2+��������ʵ���Ϊxmol������ת�Ƶ����غ��֪��NO�����ʵ���Ϊxmol��2/3������Nԭ���غ��֪��xmol��2/3+2xmol=4mol�����x=1.5����n(Fe2+)��n(Fe)�仯��ʾ��ͼΪ��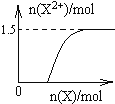 ���ʴ�Ϊ��
���ʴ�Ϊ��  ��
��