题目内容
【题目】常温下,向20.00 mL 0.100 0 mol·L-1 CH3COONa溶液中逐滴加入0.100 0 mol·L-1盐酸,混合溶液的pH与所加盐酸体积的关系如图所示。下列说法正确的是( )
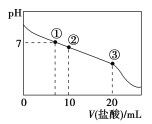
A.点①所示溶液中:c(Cl-)>c(CH3COOH)>c(OH-)=c(H+)
B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-)
D.整个过程中:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-)
【答案】C
【解析】A项,溶液中存在电荷守恒:c(H+)+c(Na+)=c(OH-)+c(CH3COO-)+c(Cl-)和物料守恒:c(Na+)=c(CH3COOH)+c(CH3COO-),点①溶液pH=7,二者联系可得c(Cl-)=c(CH3COOH),A错误。B项,在点②所示的溶液中,发生反应CH3COONa+HCl===CH3COOH+NaCl,得到的溶液中n(NaCl)=n(CH3COOH)=n(CH3COONa)。因为此溶液显酸性,所以CH3COOH的电离作用大于CH3COO-的水解作用。因此,c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH),B错误。C项,在点③所示的溶液中,恰好完全发生反应CH3COONa+HCl===CH3COOH+NaCl,得到的是CH3COOH与NaCl的混合溶液,由于醋酸是弱酸,发生电离,所以c(Na+)>c(CH3COOH),在溶液中除了存在酸的电离,还存在水的电离,因此c(H+)>c(CH3COO-),但是酸或水的电离是微弱的,所以c(CH3COOH)>c(H+)。所以在溶液中的离子的浓度关系为c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-),正确。D项,在整个过程中,根据电荷守恒可得c(H+)+c(Na+)=c(Cl-)+c(CH3COO-),根据物料守恒可得c(Na+)=c(CH3COO-)+c(CH3COOH),D错误。

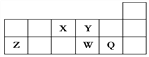
【题目】下列表格中各项都正确的一组是( )
类别选项 | 碱 | 盐 | 电解质 | 非电解质 |
A | 明矾 | 食盐 | 石墨 | 醋酸 |
B | 纯碱 | CaCO3 | NH3H2O | Fe |
C | 烧碱 | 小苏打 | BaSO4 | 干冰 |
D | KOH | CuSO4 | Na2SO4 | NaClO |
A.A
B.B
C.C
D.D