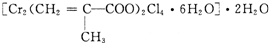题目内容
(2010?江苏一模)工业上用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2
4NO+6H2O①4NO+3O2+2H2O=4HNO3②
(1)现以1.7吨液氨为原料来生产质量分数为50%的硝酸,理论上至少需要加水的质量为
(2)工业上用Mg(NO3)2替代浓H2SO4可作为制取浓HNO3的脱水剂,现有50%(质量分数,下同)的硝酸M1吨,向其中加入80%的Mg(NO3)2溶液M2吨,蒸馏分离得到90%的硝酸和60%的Mg(NO3)2溶液(不含HNO3).若蒸馏过程中HNO3、Mg(NO3)2、H2O均无损耗,则蒸馏前的投料比M1/M2=
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:2NO2+Na2CO3=NaNO2+NaNO3+CO2③,NO+NO2+Na2CO3=2NaNO2+CO2④.现用足量的纯碱溶液来吸收硝酸工业尾气(NO和NO2),每产生22.4L(标准状况下)CO2时,吸收液质量增加44g.求硝酸工业尾气中NO和NO2的物质的量之比?
4NH3+5O2
| ||
| △ |
(1)现以1.7吨液氨为原料来生产质量分数为50%的硝酸,理论上至少需要加水的质量为
4.5
4.5
吨.(假设生产过程中反应物和生成物均无损耗)(2)工业上用Mg(NO3)2替代浓H2SO4可作为制取浓HNO3的脱水剂,现有50%(质量分数,下同)的硝酸M1吨,向其中加入80%的Mg(NO3)2溶液M2吨,蒸馏分离得到90%的硝酸和60%的Mg(NO3)2溶液(不含HNO3).若蒸馏过程中HNO3、Mg(NO3)2、H2O均无损耗,则蒸馏前的投料比M1/M2=
0.75
0.75
.(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:2NO2+Na2CO3=NaNO2+NaNO3+CO2③,NO+NO2+Na2CO3=2NaNO2+CO2④.现用足量的纯碱溶液来吸收硝酸工业尾气(NO和NO2),每产生22.4L(标准状况下)CO2时,吸收液质量增加44g.求硝酸工业尾气中NO和NO2的物质的量之比?
分析:(1)根据总反应方程式:4NH3+8O2=4HNO3+4H2O,即NH3+2O2=HNO3+H2O来计算;
(2)根据蒸馏过程中被蒸馏的水的质量,分别找出硝酸与硝酸镁中转移的水的等量关系,分别求出 M1、M2,进行分析解答本题;
(3)根据二氧化碳气体体积和溶液质量增加的量列方程组解出一氧化氮和二氧化氮的体积,从而得出其体积之比.
(2)根据蒸馏过程中被蒸馏的水的质量,分别找出硝酸与硝酸镁中转移的水的等量关系,分别求出 M1、M2,进行分析解答本题;
(3)根据二氧化碳气体体积和溶液质量增加的量列方程组解出一氧化氮和二氧化氮的体积,从而得出其体积之比.
解答:解:(1)把两个化学方程式相加:得:4NH3+8O2=4HNO3+4H2O,再去掉一个公约数4简化为:
NH3 +2O2 =HNO3 +H2O
17 63 18
1.7t X Y
X=6.3t Y=1.8t
质量分数要为50%,则整个溶液的质量为6.3吨/50%=12.6吨,所需要加的水的质量为:12.6-6.3-1.8=4.5吨,故答案为:4.5;
(2)设被转移的水的质量为X,
50%的硝酸含水量为50%,80%的硝酸镁溶液含水量为20%,90%的硝酸含水量为10%,60%的硝酸镁溶液含水量为40%.则
硝酸中水:0.5M1-X=(M1-X)×0.1
解得:M1=
X
硝酸镁中水:0.2M2+X=(M2+X)×0.4
解得:M2=3X
故
=
=
=0.75,故答案为:0.75;
(3)设NO的物质的量是x,NO2的物质的量是y,则
x+
=
mol=1mol;
32x+24(y-x)=44,
解得:x=
mol,y=
mol,即一氧化氮和二氧化氮的物质的量之比
=1:7,所以相同条件下,一氧化氮和二氧化氮的体积之比是1:7,故答案为:1:7.
NH3 +2O2 =HNO3 +H2O
17 63 18
1.7t X Y
X=6.3t Y=1.8t
质量分数要为50%,则整个溶液的质量为6.3吨/50%=12.6吨,所需要加的水的质量为:12.6-6.3-1.8=4.5吨,故答案为:4.5;
(2)设被转移的水的质量为X,
50%的硝酸含水量为50%,80%的硝酸镁溶液含水量为20%,90%的硝酸含水量为10%,60%的硝酸镁溶液含水量为40%.则
硝酸中水:0.5M1-X=(M1-X)×0.1
解得:M1=
| 9 |
| 4 |
硝酸镁中水:0.2M2+X=(M2+X)×0.4
解得:M2=3X
故
| M1 |
| M2 |
| 9X |
| 4×3X |
| 3 |
| 4 |
(3)设NO的物质的量是x,NO2的物质的量是y,则
x+
| y-x |
| 2 |
| 22.4 |
| 22.4 |
32x+24(y-x)=44,
解得:x=
| 1 |
| 4 |
| 7 |
| 4 |
| ||
|
点评:本题主要考查了化学计算,注意平时知识的积累以及灵活应用是解题的关键,难度中等.

练习册系列答案
相关题目
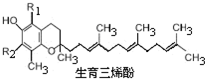 (2010?江苏一模)α,β,γ和δ四种生育三烯酚是构成维生素E的主要物质,下列叙述中不正确的是( )
(2010?江苏一模)α,β,γ和δ四种生育三烯酚是构成维生素E的主要物质,下列叙述中不正确的是( )
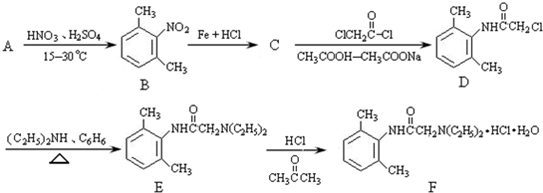
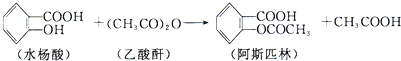
 与足量的NaOH溶液共热充分反应的化学方程式:
与足量的NaOH溶液共热充分反应的化学方程式:
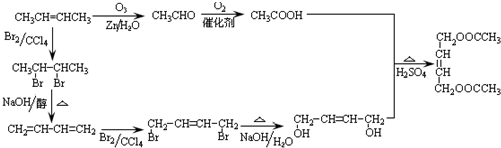
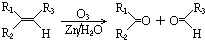
 (2010?江苏一模)过渡元素在生活、生产和科技等方面有广泛的用途.
(2010?江苏一模)过渡元素在生活、生产和科技等方面有广泛的用途.