题目内容
11.元素周期表中某区域可以寻找制备新型农药材料的元素,它们是( )| A. | 左下方区域的金属元素 | |
| B. | 右上方区域的某些非金属元素 | |
| C. | 金属元素和非金属元素分界线附近的元素 | |
| D. | 过渡元素区域 |
分析 A.周期表左下角的元素具有较强的金属性,为电的良导体,不可以作半导体材料;
B.周期表右上角的元素常用于制备农药;
C.金属元素和非金属元素分界线附近的意元素多为半导体材料元素;
D.过渡元素常用于制备催化剂材料及耐高温、耐腐蚀材料.
解答 解:A.周期表左下角的元素具有较强的金属性,为电的良导体,不可以作半导体材料,故不选;
B.周期表右上角的元素常用于制备农药,故选;
C.金属元素和非金属元素分界线附近的意元素多为半导体材料元素,故不选;
D.过渡元素常用于制备催化剂材料及耐高温、耐腐蚀材料,故不选;
故选B.
点评 本题考查元素周期表的结构与应用,比较基础,明确半导体材料具有的性质,根据元素周期表中的元素分布及元素常见的性质来解答.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
1.在一定温度下,向饱和苛性钠溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,下列有关说法中,正确的是( )
| A. | 溶液中Na+浓度增大,有O2放出 | B. | 溶液的碱性不变,有H2放出 | ||
| C. | 溶液中Na+数目减少,有O2放出 | D. | 溶液的碱性不变,有O2放出 |
2.已知aAn+,bB(n+1)+,cCn-,dD(n+1)-是具有相同的电子层结构的短周期元素形成的简单离子,下列叙述正确的是( )
| A. | 最外层电子数:C>D>A>B | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:Cn->D(n+1)->An+>B(n+1)+ | D. | 单质还原性:B>A>C>D |
19.下列叙述正确的是( )
| A. | 铜锌稀硫酸形成的原电池放电时,溶液中阳离子向铜电极移动 | |
| B. | 燃料电池在使用时发生了燃料的燃烧 | |
| C. | 增大反应物的用量,反应速率一定加快 | |
| D. | 可逆反应达到一定限度后,因各物质的浓度不变,说明反应已经停止 |
6.某高聚物可表示为: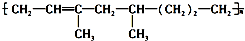 下列有关其叙述不正确的是( )
下列有关其叙述不正确的是( )
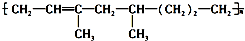 下列有关其叙述不正确的是( )
下列有关其叙述不正确的是( )| A. | 该高聚物是通过加聚反应生成的 | |
| B. | 合成该高聚物的单体有三种 | |
| C. | 1mol该物质能与1molH2加成,生成不含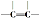 的物质 的物质 | |
| D. | 该高聚物能被酸性KMnO4溶液氧化 |
3.NA是阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.00mol NaCl中含有NA个NaCl分子 | |
| B. | 1.00mol NaCl中,所有Na+的最外层电子总数为8NA | |
| C. | 欲配制1.00L,1.00mol•L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 | |
| D. | 标准状况下,11.2LCH3CH2OH中含有分子的数目为0.5NA |
20.氰气[(CN)2]和氰化物都是剧毒性物质,氰分子的结构式为N≡C-C≡N,性质与卤素相似,下列叙述错误的是( )
| A. | 氰分子中四原子共直线 | |
| B. | 氰分子中C≡N键长大于C≡C键长 | |
| C. | 氰气分子中含有σ键和π键 | |
| D. | 氰化氢在一定条件下能与烯烃发生加成反应 |
2.一定温度下,在三个体积均为1L的密闭容器中发生反应:CO(g)+H2O(g)?CO2(g)+H2(g).下列说法正确的是( )
| 实验编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | ||
| ① | 430 | 1 | 1 | 0.95 | 0.95 |
| ② | 830 | 1 | 1 | 0.5 | 0.5 |
| ③ | 830 | 1.5 | 1 | ||
| A. | 正反应的△H>0 | B. | CO转化率③>② | ||
| C. | 实验①达到平衡的时间比②短 | D. | 430℃时,该反应的平衡常数为361 |
 某校化学兴趣学习小组实验探究乙醇的性质.
某校化学兴趣学习小组实验探究乙醇的性质.