题目内容
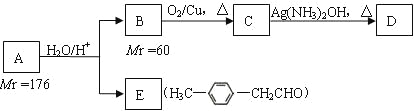
【题目】A、B、C、D、E 为原子序数依次增大的短周期元素。A、C处于同一主族,C、D、E 处于同一周期,E 原子的最外层电子数是 A、B、C原子最外层电子数之和。A、B 组成的常见气体 X 能使湿润的红色石蕊试纸变蓝;D 的单质既能与C元素最高价氧化物的水化物的溶液反应生成盐,也能与A、E 形成的化合物的水溶液反应生成盐。下列说法正确的是( )
A.原子半径的大小顺序:C>D>E>A>B
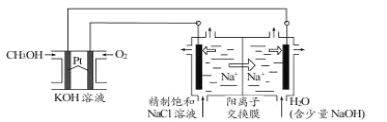
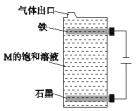
B.C、E组成的化合物M 用右图装置进行电解能得到大量的 E 单质
C.元素B、E的最高价氧化物对应的水化物的酸性:B>E
D.C元素的氧化物中阴、阳离子数目之比为1:2
【答案】D
【解析】
A、B 组成的常见气体 X 能使湿润的红色石蕊试纸变蓝,则A为H、B为N,X为NH3;A与C同族,且C的原子序数大于N,则C为Na,所以E的最外层电子数为1+1+5=7,则E为Cl,D的单质技能与NaOH反应也能与HCl反应,则D为Al。
A.电子层数越多半径越大,电子层数相同则原子序数越小半径越大,所以原子半径的大小为:Na>Al>Cl>N>H,即C>D>E>B>A,故A错误;
B.C、E组成的化合物为NaCl,如图装置电解饱和氯化钠溶液时,石墨电极为阳极,氯离子放电生成氯气,铁电极为阴极,氢离子放电生成氢气,同时产生大量氢氧根,氯气的密度比水小,无法溶于水的氯气会上浮到铁电极附近与氢氧根反应生成氯离子和次氯酸跟,无法得到大量的氯气单质,故B错误;
C.N的非金属性小于Cl的非金属性,所以最高价氧化物对应的水化物的酸性:N<Cl,故C错误;
D.C元素为Na,其氧化物为Na2O,其中阴、阳离子数目之比为1:2,故D正确;
故答案为D。

练习册系列答案
相关题目