题目内容
【题目】下图表示元素周期表的前三周期,表中的字母各代表一种元素,请回答下列问题:
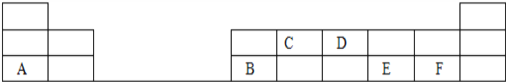
①写出D单质的电子式____________;A与E的上一周期同主族元素形成的原子个数比为1:1的化合物的电子式_______________。
②E和F分别形成的气态氢化物中较稳定的是(填写氢化物的化学式)_____________;
③A的最高价氧化物对应的水化物中所含化学键为___________________,其水溶液与B单质反应的离子方程式为___________________________;
④写出实验室制备F单质的化学方程式______________________________________。
⑤将Fe与C的一种单质(导体)用导线连接,共同浸入到食盐水中构成闭合回路,其中C极为_____极(填正或负),该电极反应式为:____________________。
⑥以D2H4和O2为原料,与KOH溶液形成的原燃料电池中,负极反应式为___________,
(生成物对环境友好无污染)
当外电路转移0.2 mol电子时,消耗的O2在标准状况下的体积为___________。
【答案】 ![]()
![]() HCl 离子键、共价键 2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑ MnO2+4HCl(浓)
HCl 离子键、共价键 2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑ MnO2+4HCl(浓)![]() MnCl2+Cl2+2H2O 正 O2+4e-+2H2O=4OH- N2H4 - 4e- + 4OH- = N2 +4H2O 1.12L
MnCl2+Cl2+2H2O 正 O2+4e-+2H2O=4OH- N2H4 - 4e- + 4OH- = N2 +4H2O 1.12L
【解析】由表可知,ABCDEF分别为钠、铝、碳、氮、硫、氯等元素。
①D单质氮气的电子式![]() ;A与E的上一周期同主族元素形成的原子个数比为1:1的化合物是过氧化钠,其电子式为
;A与E的上一周期同主族元素形成的原子个数比为1:1的化合物是过氧化钠,其电子式为![]() 。
。
②E和F分别形成的气态氢化物中较稳定的是HCl;
③A的最高价氧化物对应的水化物氢氧化钠中所含化学键为离子键、共价键,其水溶液与B单质反应的离子方程式为2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑;
④实验室用浓盐酸和二氧化锰加热的方法制备氯气,化学方程式MnO2+4HCl(浓)![]() MnCl2+Cl2+2H2O 。
MnCl2+Cl2+2H2O 。
⑤将Fe与C的一种单质(导体)用导线连接,共同浸入到食盐水中构成闭合回路,类比钢铁的电化学腐蚀, C极为正极,该电极反应式为:O2+4e-+2H2O=4OH-。
⑥以D2H4和O2为原料,与KOH溶液形成的原燃料电池,因为生成物对环境友好无污染,可知产物为氮气和水,所以负极反应式为N2H4 - 4e- + 4OH- = N2 +4H2O ,当外电路转移0.2 mol电子时,消耗的O2在标准状况下的体积为1.12L 。

 小学课时特训系列答案
小学课时特训系列答案