题目内容
(7分)
(1)常温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得如下数据:
x= ____________ ;Ba(OH)2溶液的物质的量浓度为____
(2)常温下,向100mL pH=2的硫酸与硫酸钠的混合溶液中,加入300mL上述Ba(OH)2溶液,沉淀正好达最大量,此时溶液的pH ______7(填“>”“<” 或“=”);原混合溶液中硫酸钠的物质的量浓度为
(1)常温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得如下数据:
| 序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 12 |
| ② | 22.00 | 18.00 | 11 |
| ③ | 22.00 | 22.00 | 7 |
(2)常温下,向100mL pH=2的硫酸与硫酸钠的混合溶液中,加入300mL上述Ba(OH)2溶液,沉淀正好达最大量,此时溶液的pH ______7(填“>”“<” 或“=”);原混合溶液中硫酸钠的物质的量浓度为
(1)2 , 0.005 mol·L-1 (每空2分,不带单位扣1分)
(2) > (1分) 0.01 mol·L-1 (2分,不带单位扣1分)
(2) > (1分) 0.01 mol·L-1 (2分,不带单位扣1分)
(1)氢氧化钡中OH-的浓度是0.01mol/L,则氢氧化钡的浓度是 0.005 mol·L-1。恰好反应时,消耗盐酸是22.00m,所以盐酸的浓度为0.01mol/L,则pH=2。300ml氢氧化钡中OH-的物质的量是0.003mol,混合液中氢离子是0.001mol,所以剩余OH-的物质的量是0.002mol,溶液显碱性。混合物中硫酸是0.0005mol,消耗氢氧化钡也是0.0005mol。则和硫酸钠反应的氢氧化钡是0.005 mol·L-1 ×0.3L-0.0005mol=0.001mol,所以浓度是0.001mol÷0.1L==0.01mol/L。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
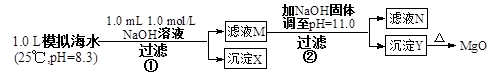
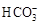
 =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( ) H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是 Ca(OH)2(aq),
Ca(OH)2(aq),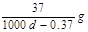
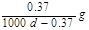


 Ag+(aq)+Cl-(aq)溶解平衡,现将足量氯化银分别放入同温下的:①100mL蒸馏水中,②100mL0.1mol·L-1盐酸中,③100mL0.1mol·L-1氯化铝溶液中,④100mL0.1mol·L-1氯化镁溶液中。充分搅拌后,银离子浓度由大到小的顺序是
Ag+(aq)+Cl-(aq)溶解平衡,现将足量氯化银分别放入同温下的:①100mL蒸馏水中,②100mL0.1mol·L-1盐酸中,③100mL0.1mol·L-1氯化铝溶液中,④100mL0.1mol·L-1氯化镁溶液中。充分搅拌后,银离子浓度由大到小的顺序是