题目内容
(1)质量相等的两种物质SO2和SO3,两种物质中分子物质的量之比为______,所含氧原子个数之比为______;(2)20.6g NaR 含有Na+0.2mol,则NaR的摩尔质量为______g/mol,则含R 8.0g 的NaR的物质的量为______mol;
(3)在标准状况下,4.8g甲烷(CH4)所占的体积为______L,它与标准状况下______L硫化氢(H2S)含有相同数目的氢原子;
(4)中和浓度为4mol/L,体积为25mLH2SO4溶液,需要NaOH的质量为______ g;
(5)已知8gA能与32gB恰好完全反应,生成22gC和一定量D,现将16gA与70gB的混合物充分反应后,生成2molD和一定量C,则D的摩尔质量为______ g/mol.
【答案】分析:(1)由n=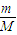 可知质量相等,物质中分子物质的量之比与摩尔质量成反比;每个SO2和SO3分子含有的原子数目分别为2、3,再结合分子数目之比,计算含有的O原子数目之比;
可知质量相等,物质中分子物质的量之比与摩尔质量成反比;每个SO2和SO3分子含有的原子数目分别为2、3,再结合分子数目之比,计算含有的O原子数目之比;
(2)Na+为0.2mol,故NaR为0.2mol,根据M=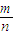 计算NaR的摩尔质量;
计算NaR的摩尔质量;
根据NaR的摩尔质量计算R-的摩尔质量,再根据n=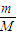 计算R-的物质的量,NaR的物质的量等于R-的物质的量;
计算R-的物质的量,NaR的物质的量等于R-的物质的量;
(3)根据n= 计算甲烷的物质的量,再根据V=nVm计算甲烷的体积;
计算甲烷的物质的量,再根据V=nVm计算甲烷的体积;
由于H原子数目相同,故n(H2S)=2n(CH4),再根据V=nVm计算硫化氢的体积;
(4)发生反应H2SO4+2NaOH=Na2SO4+2H2O,据此计算氢氧化钠的物质的量,再根据m=nM计算氢氧化钠的质量;
(5)8gA能与32gB恰好完全反应,生成22gC和一定量D,根据质量守恒D的质量为8g+32g-22g=18g,故A、B、C、D按质量比8g:32g:22g:18g=4:16:11:9进行反应,据此进行16gA与70gB反应的过量计算,再根据质量比计算生成的D的质量,利用M=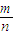 计算D的摩尔质量.
计算D的摩尔质量.
解答:解:(1)质量相等的两种物质SO2和SO3,两种物质中分子物质的量之比与摩尔质量成反比,即为80gmol:64g/mol=5:4;
每个SO2和SO3分子含有的原子数目分别为2、3,二者含有的O原子数目之比为5×2:4×3=5:6;
故答案为:5:4;5:6;
(2)20.6g NaR含有Na+为0.2mol,故NaR为0.2mol,根据M=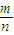 计算NaR的摩尔质量为:
计算NaR的摩尔质量为: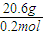 =103g/mol;
=103g/mol;
R-的摩尔质量为103g/mol-23g/mol=80g/mol,8gR-的物质的量为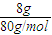 =0.1mol,NaR的物质的量等于R-的物质的量,所以含R8.0g的NaR的物质的量为0.1mol;
=0.1mol,NaR的物质的量等于R-的物质的量,所以含R8.0g的NaR的物质的量为0.1mol;
故答案为:103;0.1;
(3)4.8g甲烷的物质的量为: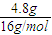 =0.3mol,标准状况下所占的体积为:0.3mol×22.4L/mol=6.72L;
=0.3mol,标准状况下所占的体积为:0.3mol×22.4L/mol=6.72L;
由于二者H原子数目相同,故n(H2S)=2n(CH4)=0.3mol×2=0.6mol,
故硫化氢的体积为:0.6mol×22.4L/mol=13.44L;
故答案为:6.72;13.44;
(4)25mL4mol/LH2SO4溶液中n(H2SO4)=0.025L×4mol/L=0.1mol,根据反应H2SO4+2NaOH=Na2SO4+2H2O可知,需要氢氧化钠的物质的量为0.1mol×2=0.2mol,故需要氢氧化钠的质量为:0.2mol×40g/mol=8g;
故答案为:8;
(5)8gA能与32gB恰好完全反应,生成22gC和一定量D,根据质量守恒D的质量为8g+32g-22g=18g,故A、B、C、D按质量比8g:32g:22g:18g=4:16:11:9进行反应,16gA完全反应需要B的质量为16g×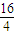 =64g<70g,故B过量,生成的D的质量为16g×
=64g<70g,故B过量,生成的D的质量为16g× =36g,故D的摩尔质量为
=36g,故D的摩尔质量为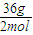 =18g/mol;
=18g/mol;
故答案为:18.
点评:考查常用化学计量的有关计算、根据方程式的计算等,比较基础,注意公式的灵活运用与基础知识的掌握.
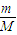 可知质量相等,物质中分子物质的量之比与摩尔质量成反比;每个SO2和SO3分子含有的原子数目分别为2、3,再结合分子数目之比,计算含有的O原子数目之比;
可知质量相等,物质中分子物质的量之比与摩尔质量成反比;每个SO2和SO3分子含有的原子数目分别为2、3,再结合分子数目之比,计算含有的O原子数目之比;(2)Na+为0.2mol,故NaR为0.2mol,根据M=
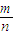 计算NaR的摩尔质量;
计算NaR的摩尔质量;根据NaR的摩尔质量计算R-的摩尔质量,再根据n=
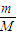 计算R-的物质的量,NaR的物质的量等于R-的物质的量;
计算R-的物质的量,NaR的物质的量等于R-的物质的量;(3)根据n=
 计算甲烷的物质的量,再根据V=nVm计算甲烷的体积;
计算甲烷的物质的量,再根据V=nVm计算甲烷的体积;由于H原子数目相同,故n(H2S)=2n(CH4),再根据V=nVm计算硫化氢的体积;
(4)发生反应H2SO4+2NaOH=Na2SO4+2H2O,据此计算氢氧化钠的物质的量,再根据m=nM计算氢氧化钠的质量;
(5)8gA能与32gB恰好完全反应,生成22gC和一定量D,根据质量守恒D的质量为8g+32g-22g=18g,故A、B、C、D按质量比8g:32g:22g:18g=4:16:11:9进行反应,据此进行16gA与70gB反应的过量计算,再根据质量比计算生成的D的质量,利用M=
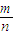 计算D的摩尔质量.
计算D的摩尔质量.解答:解:(1)质量相等的两种物质SO2和SO3,两种物质中分子物质的量之比与摩尔质量成反比,即为80gmol:64g/mol=5:4;
每个SO2和SO3分子含有的原子数目分别为2、3,二者含有的O原子数目之比为5×2:4×3=5:6;
故答案为:5:4;5:6;
(2)20.6g NaR含有Na+为0.2mol,故NaR为0.2mol,根据M=
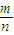 计算NaR的摩尔质量为:
计算NaR的摩尔质量为: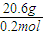 =103g/mol;
=103g/mol;R-的摩尔质量为103g/mol-23g/mol=80g/mol,8gR-的物质的量为
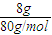 =0.1mol,NaR的物质的量等于R-的物质的量,所以含R8.0g的NaR的物质的量为0.1mol;
=0.1mol,NaR的物质的量等于R-的物质的量,所以含R8.0g的NaR的物质的量为0.1mol;故答案为:103;0.1;
(3)4.8g甲烷的物质的量为:
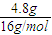 =0.3mol,标准状况下所占的体积为:0.3mol×22.4L/mol=6.72L;
=0.3mol,标准状况下所占的体积为:0.3mol×22.4L/mol=6.72L;由于二者H原子数目相同,故n(H2S)=2n(CH4)=0.3mol×2=0.6mol,
故硫化氢的体积为:0.6mol×22.4L/mol=13.44L;
故答案为:6.72;13.44;
(4)25mL4mol/LH2SO4溶液中n(H2SO4)=0.025L×4mol/L=0.1mol,根据反应H2SO4+2NaOH=Na2SO4+2H2O可知,需要氢氧化钠的物质的量为0.1mol×2=0.2mol,故需要氢氧化钠的质量为:0.2mol×40g/mol=8g;
故答案为:8;
(5)8gA能与32gB恰好完全反应,生成22gC和一定量D,根据质量守恒D的质量为8g+32g-22g=18g,故A、B、C、D按质量比8g:32g:22g:18g=4:16:11:9进行反应,16gA完全反应需要B的质量为16g×
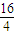 =64g<70g,故B过量,生成的D的质量为16g×
=64g<70g,故B过量,生成的D的质量为16g× =36g,故D的摩尔质量为
=36g,故D的摩尔质量为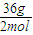 =18g/mol;
=18g/mol;故答案为:18.
点评:考查常用化学计量的有关计算、根据方程式的计算等,比较基础,注意公式的灵活运用与基础知识的掌握.

练习册系列答案
相关题目