题目内容
(每空各2 分,共16分)
(1)质量相等的两种物质SO2和SO3,两种物质中分子物质的量之比为___________ ,所含氧原子个数之比为___________
(2)20.6g NaR 含有Na+0.2mol,则NaR的摩尔质量为___________ g/mol,则含R 8.0g 的
NaR的物质的量为___________ mol
(3)在标准状况下,4.8g甲烷(CH4)所占的体积为_________L,它与标准状况下________L硫化氢(H2S)含有相同数目的氢原子。
(4)中和浓度为4mol/L,体积为25mLH2SO4溶液,需要NaOH的质量为___________ g。
(5)已知8gA能与32gB恰好完全反应,生成22gC和一定量D,现将16gA与70gB的混合物充分反应后,生成2molD和一定量C,则D的摩尔质量为 __ _ g/mol.
(每个空2 分,共16分)(1)5:4 5:6 (2)103 0.1
(3)6.72 13.44 (4)8.0 (5)18
【解析】(1)根据n=m/M可知,在质量相等的条件下,SO2和SO3两种物质中分子物质的量之比为80︰64=5︰4。根据化学式可知,所含氧原子个数之比为5×3︰4×2=5︰6。
(2)20.6g NaR 含有Na+0.2mol,则NaR物质的量是0.2mol,所以摩尔质量是20.6g÷0.2mol=103g/mol,因此R的相对原子质量是103-23=80,所以8gR的物质的量是0.1mol,则NaR的物质的量也是0.1mol。
(3)在标准状况下,4.8g甲烷(CH4)所占的体积为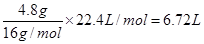 。其中氢原子的物质的量是0.3mol×4=1.2mol,则H2S的物质的量是0.6mol,标准状况下的体积是0.6mol×22.4L/mol=13.44L。
。其中氢原子的物质的量是0.3mol×4=1.2mol,则H2S的物质的量是0.6mol,标准状况下的体积是0.6mol×22.4L/mol=13.44L。
(4)稀硫酸的物质的量是0.025L×4mol/L=0.1mol,所以根据H2SO4+2NaOH=Na2SO4+2H2O可知,需要0.2mol氢氧化钠,质量是0.2mol×40g/mol=8.0g。
(5)根据质量守恒定律可知,生成D是8g+32g-22g=18g。则将16gA与70gB的混合物充分反应后,生成36gD,所以D的摩尔质量是36g÷2mol=18g/mol。

(1)题每空1分,(1)题3分,其余各2分,共15分)
某校化学课外活动小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验。实验室提供如下药品:①2%NaOH溶液②稀HCl③稀H2SO4④饱和KHCO3溶液⑤浓H2SO4⑥CaCO3固体⑦K2CO3粉末⑧纯水。提供如下仪器装置:
请根据题目要求回答下列问题:
(l)请按下表要求,填写选择的装置和药品
| 分项 内容 | CO2发生装置(X) 随开随用,随关随停 | 除杂洗气装置(Y) | 制备产品装置(Z) |
| 选择的装置(填序号) | | | C |
| 选择的药品(填序号) | | | ① |
 发生装置(X)的气密性,请写出主要操作过程:
发生装置(X)的气密性,请写出主要操作过程:_____________________________________________________________________________
__________________________________________________________________________。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为________________,Y装置中除去的杂质为_____________,
(4)常温下,向Z装置的NaOH溶液中通入过量
 气体,其原因是_________________;通入过量
气体,其原因是_________________;通入过量 后,Z装置内的溶液中离子浓度大小顺序为:_______________________ 。
后,Z装置内的溶液中离子浓度大小顺序为:_______________________ 。 (1)题每空1分,(1)题3分,其余各2分,共15分)
某校化学课外活动小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验。实验室提供如下药品:①2%NaOH溶液②稀HCl③稀H2SO4④饱和KHCO3溶液⑤浓H2SO4⑥CaCO3固体⑦K2CO3粉末⑧纯水。提供如下仪器装置:

请根据题目要求回答下列问题:
(l)请按下表要求,填写选择的装置和药品
|
分项 内容 |
CO2发生装置(X) 随开随用,随关随停 |
除杂洗气装置(Y) |
制备产品装置(Z) |
|
选择的装置(填序号) |
|
|
C |
|
选择的药品(填序号) |
|
|
① |
(2)如何检验所选择的 发生装置(X)的气密性,请写出主要操作过程:
发生装置(X)的气密性,请写出主要操作过程:
_____________________________________________________________________________
__________________________________________________________________________。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为________________,Y装置中除去的杂质为_____________,
(4)常温下,向Z装置的NaOH溶液中通入过量 气体,其原因是_________________;通入过量
气体,其原因是_________________;通入过量 后,Z装置内的溶液中离子浓度大小顺序为:_______________________
。
后,Z装置内的溶液中离子浓度大小顺序为:_______________________
。