��Ŀ����
����Ŀ��Ϊ��ʵ����ˮ���Ρ���ij�������ۺϴ�����NH4+��ˮ��ҵ��������Ҫ��N2��CO2��SO2��NO��CO�������������ɷ֣����������ͼ���̣� 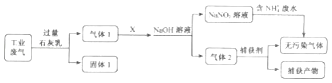
��1������I����Ҫ�ɷ�Ϊ �� ������������������Ҫ�� ��
��2��������NH4+��ˮʱ��������Ӧ�����ӷ���ʽΪ ��
��3����XΪ�����������ϸ���ƿ���������ԭ���� ��
��4����ҵ�����е�SO2��NO���ɲ���NaClO2��Һ��Ϊ���ռ����о������ڹ��ݷ�Ӧ����ͨ�뺬��SO2��NO����������Ӧ�¶�Ϊ323K��NaClO2��ҺŨ��Ϊ5��10��3molL��1 �� ��Ӧһ��ʱ�����Һ������Ũ�ȵķ�����������
���� | SO42�� | SO32�� | NO3�� | NO2�� | Cl�� |
c��molL��1�� | 8.35��10��4 | 6.87��10��6 | 1.5��10��4 | 1.2��10��5 | 3.4��10��3 |
��д��NaClO2��Һ������������Ҫ��Ӧ�����ӷ���ʽ ��
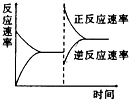
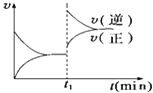
����ѹǿ��NO��ת���������ߡ��������䡱���͡�����
���������շ�Ӧ�Ľ��У����ռ���Һ��pH��������������䡱��С������
���������NaClO��Ca��ClO��2���NaClO2 �� Ҳ�ܵõ��Ϻõ���������Ч�����ӻ�ѧƽ��ԭ��������Ca��ClO��2���NaClO���е��ŵ��� ��
���𰸡�
��1��CaCO3��CaSO3��Ca��OH��2��CO
��2��NH4++NO2��=N2��+2H2O
��3�����������ὫNO������NO3�� �� ����NH4+������Ӧ
��4��3ClO2��+4NO+4OH��=4NO3��+3Cl��+2H2O����ߣ���С��Ca2+��SO42���������CaSO4������ʹƽ������﷽���ƶ���SO2ת�������
���������⣺��1��������������֪����I����Ҫ�ɷ�ΪCaCO3��CaSO3��Ca��OH��2 �� ������������������Ҫ��CO�����Դ��ǣ�CaCO3��CaSO3��Ca��OH��2��CO����2��������NH4+��ˮʱ��������Ӧ�����ӷ���ʽΪNH4++NO2��=N2��+2H2O�����Դ��ǣ�NH4++NO2��=N2��+2H2O����3����XΪ�����������ϸ���ƿ���������ԭ���ǹ��������ὫNO������NO3�� �� ����NH4+������Ӧ�� ���Դ��ǣ����������ὫNO������NO3�� �� ����NH4+������Ӧ����4�����������ƾ��������ԣ���NaClO2��Һ�ʼ��ԣ���NaClO2��Һ������������Ҫ��Ӧ�����ӷ���ʽΪ3ClO2��+4NO+4OH��=4NO3��+3Cl��+2H2O������Ӧ�������С�ģ�������ѹǿ��NO��ת������ߣ�
���Դ��ǣ�3ClO2��+4NO+4OH��=4NO3��+3Cl��+2H2O����ߣ��ڸ��ݷ�Ӧ�ķ���ʽ3ClO2��+4NO+4OH��=4NO3��+3Cl��+2H2O��֪�������շ�Ӧ�Ľ������������ӱ����ģ����ռ���Һ��pH���ͣ�
���Դ��ǣ���С����4NO+3ClO2��+4OH��=4NO3��+3Cl��+2H2O����2�֣�2H2O+3ClO2��+4NO=4NO3��+3Cl��+4H+Ҳ���֣���ߣ�1�֣� �ڼ�С��1�֣��۴ӻ�ѧƽ��ԭ��������Ca��ClO��2���NaClO���е��ŵ���Ca2+��SO42���������CaSO4������ʹƽ������﷽���ƶ���SO2ת������ߣ�
���Դ��ǣ�Ca2+��SO42���������CaSO4������ʹƽ������﷽���ƶ���SO2ת������ߣ�