题目内容
在一定条件下发生反应2SO2(g)+O2(g)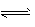 2SO3(g);正反应放热。
2SO3(g);正反应放热。
(1)500℃时,将a mol SO2与b mol O2以3:2通入固定容积为5L的密闭容器中。
①反应进行至10min时,测得n(SO2)=8mol,n(SO3)=4mol,则b=_______mol。
②10min内平均速率v(SO2)=____。
③反应达到平衡后,测得容器内压强是反应起始压强的0.715倍,则平衡时c(SO3)=______,SO2的转化率α1 (SO2)=_____。
(2)当反应温度、起始SO2与O2物质的量均与(1)相同时,将其混合气通入一恒压反应容器中,达平衡时SO2的转化率与(1)中转化率的关系是___________(填=、>或<)
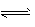 2SO3(g);正反应放热。
2SO3(g);正反应放热。 (1)500℃时,将a mol SO2与b mol O2以3:2通入固定容积为5L的密闭容器中。
①反应进行至10min时,测得n(SO2)=8mol,n(SO3)=4mol,则b=_______mol。
②10min内平均速率v(SO2)=____。
③反应达到平衡后,测得容器内压强是反应起始压强的0.715倍,则平衡时c(SO3)=______,SO2的转化率α1 (SO2)=_____。
(2)当反应温度、起始SO2与O2物质的量均与(1)相同时,将其混合气通入一恒压反应容器中,达平衡时SO2的转化率与(1)中转化率的关系是___________(填=、>或<)
(1)8 ;0.08mol/(L·min);2.28mol/L ;0.95
(2)﹥
(2)﹥

练习册系列答案
相关题目
 如图是一些重要工业生产的转化关系(反应条件略去):
如图是一些重要工业生产的转化关系(反应条件略去):






 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题: