题目内容
(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:

①第ⅡA族元素的价电子数________。
②第三周期元素的最高正价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物对应的水化物的化学式为_______________。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,A溶液中水的电离程度比B溶液中水的电离程度小。则化合物A中的化学键类型为________,B的化学式为________。
③工业上制取单质M的化学方程式为____________________________。
(1)①b ②c ③a
(2)①HClO4 ②离子键、(极性)共价键 NaClO或NaHS ③SiO2+2C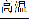 Si+2CO↑
Si+2CO↑
【解析】 (1)第ⅡA族元素的价电子数全部为2,是相等的;第三周期元素的最高正价是从+1价→+7价,依次增大;F-、Na+、Mg2+、Al3+的离子半径依次减小。
(2)Y原子最外层电子数与核外电子总数之比为3∶4,推断Y为O;根据M元素原子的最外层电子数与电子层数之比为4∶3,推断M为Si;再根据X、Y、Z、M、N的原子序数依次增大,离子的化合价及N-、Z+、X+的离子半径逐渐减小得出X为H,Z为Na,N为Cl(化合物XN常温下为气体,排除X为Li的可能),化合物A、B分别为A为NaOH,B为NaClO或NaHS。

 全能闯关100分系列答案
全能闯关100分系列答案短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
|
| R |
|
T | Q |
| W |
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.含T的盐溶液一定显酸性
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
阴离子 | Cl- CO32— NO3— SO42— SiO32— I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是____________。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是
___________________________________________________________。
(3)甲同学最终确定原溶液中所含阳离子有________,阴离子有________;并据此推测原溶液应该呈_______________________________________________性,原因是_________________________________(请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为__________________________________________________________。
充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。