题目内容
【题目】根据要求完成下列问题:
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:
该元素核外价电子排布图_____________,电子排布式_____________________。该元素的原子序数为______,该元素是______元素(填“金属”或“非金属”),形成的单质为______晶体。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:_________、__________、________。
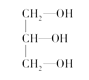
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。_____

(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧、PCl3中,属于非极性分子的是(填番号)________________。
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4________H2SO3; HClO3________HClO4; H3PO4________H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
①NH3中心原子的杂化方式为______杂化,VSEPR构型为__________,分子的立体构型为__________________。
②BF3分子中,中心原子的杂化方式为________杂化,分子的立体构型为____________。
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于_________________.
【答案】 ![]() 1s22s22p63s23p63d14s2 21 金属 金属 Co3+ CN- 6
1s22s22p63s23p63d14s2 21 金属 金属 Co3+ CN- 6  ①③④⑦ > < > sp3 正四面体形 三角锥形 sp2 平面(正)三角形 水分子之间除了有范德华力还有氢键而硫化氢分子之间只有范德华力。(合理即可)
①③④⑦ > < > sp3 正四面体形 三角锥形 sp2 平面(正)三角形 水分子之间除了有范德华力还有氢键而硫化氢分子之间只有范德华力。(合理即可)
【解析】(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,价电子排布式为3d14s2,其价电子排布图为:![]() ,其基态原子核外电子排布式为:1s22s22p63s23p63d14s2,原子序数为21,处于第四周期ⅢB族,属于金属元素,形成金属晶体,故答案为:
,其基态原子核外电子排布式为:1s22s22p63s23p63d14s2,原子序数为21,处于第四周期ⅢB族,属于金属元素,形成金属晶体,故答案为:![]() ;1s22s22p63s23p63d14s2;21;金属;金属;
;1s22s22p63s23p63d14s2;21;金属;金属;
(2)根据配合物K3[Co(CN)6]结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Co3+、有孤对电子的原子或离子为配体,所以配体为CN-、配位数就是配体的个数,所以配位数为6,故答案为:Co3+;CN-;6;
(3)连接4个不同原子或原子团的碳原子为手性碳原子,所以手性碳原子前者有,后者没有,故答案为: ;
;
(4)①CO2中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;②NH3中C元素化合价为-3,N原子最外层5个电子未全部成键,为极性分子;③CCl4中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;④BF3中B元素化合价为+3,B原子最外层3个电子全部成键,为非极性分子;⑤H2O中O元素化合价为-2,O原子最外层6个电子未全部成键,为极性分子;⑥SO2中S元素化合价为+4,S原子最外层6个电子未全部成键,为极性分子;⑦SO3中S元素化合价为+6,S原子最外层6个电子全部成键,为非极性分子;⑧PCl3中P元素化合价为+3,P原子最外层5个电子未全部成键,为极性分子;故选①③④⑦;
(5)同一元素的含氧酸,该元素的化合价越高,对应的含氧酸的酸性越强,故酸性:H2SO4>H2SO3,HClO3<HClO4;H3PO4>H3PO3。故答案为:>;<;>;
(6)①NH3分子中心N原子孤电子对数=![]() (51×3)=1,价层电子对数=3+1=4,故N原子采取sp3杂化,VSEPR构型为正四面体,分子的立体构型为三角锥形,故答案为:sp3;正四面体;三角锥形;
(51×3)=1,价层电子对数=3+1=4,故N原子采取sp3杂化,VSEPR构型为正四面体,分子的立体构型为三角锥形,故答案为:sp3;正四面体;三角锥形;
②BF3分子中心B原子孤电子对数=![]() (33×1)=0,价层电子对数=3+0=34,故B原子采取sp2杂化,VSEPR构型为平面三角形,分子的立体构型为平面三角形,故答案为:sp2;平面三角形
(33×1)=0,价层电子对数=3+0=34,故B原子采取sp2杂化,VSEPR构型为平面三角形,分子的立体构型为平面三角形,故答案为:sp2;平面三角形
(7) 水分子之间除了有范德华力还有氢键, 而硫化氢分子之间只有范德华力,导致H2O的沸点(100℃)比H2S的沸点(-61℃)高,故答案为:水分子之间除了有范德华力还有氢键, 而硫化氢分子之间只有范德华力。

【题目】Ca3N2某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。

(1)仪器B的名称是_____________,B中固体物质为_______________。
(2)反应过程中末端导管必须插入试管C的水中,目的是______。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(3)将制备氮化钙的操作步骤补充完整:
①打开活塞K并通入N2;
②点燃酒精灯,进行反应;
③反应结束后,__________________。
(4)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=______。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_________________,设计实验检验Ca3N2与水反应产物的操作及现象__________________。

