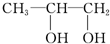
题目内容
18.已知x、y、z元素的原子具有相同的电子层数,最高价氧化物对应水化物酸性依次增强,则下列判断正确的是( )| A. | 原子半径按x、y、z顺序增大 | B. | 阴离子的还原性按x、y、z顺序增强 | ||
| C. | 单质的氧化性按x、y、z顺序增强 | D. | 氢化物的稳定性按x、y、z顺序减弱 |
分析 x、y、z元素的原子具有相同的电子层数,则处于同周期,非金属性越强,最高价氧化物对应水化物的酸性越强,而最高价氧化物对应水化物的酸性是:x<y<z,则非金属性x<y<z,同周期元素的原子从左到右,原子半径逐渐减小、元素非金属性增强、氢化物的稳定性逐渐增强、单质氧化性增强、阴离子还原性减弱.
解答 解:x、y、z元素的原子具有相同的电子层数,则处于同周期,非金属性越强,最高价氧化物对应水化物的酸性越强,而最高价氧化物对应水化物的酸性是:x<y<z,则非金属性x<y<z,
A.同周期元素的原子从左到右,原子半径逐渐减小,非金属性增强,所以原子半径:x>y>z,故A错误;
B.非金属性x<y<z,非金属性越强,阴离子还原性越弱,故B错误;
C.非金属性x<y<z,非金属性越强,单质氧化性越强,故C正确;
D.非金属性越强,氢化物越稳定,由于非金属性x<y<z,所以气态氢化物的稳定性:x<y<z,故D正确;
故选C.
点评 本题考查元素周期律知识,题目难度不大,注意理解掌握同周期元素性质的递变规律,有利于基础知识的巩固.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
9.把质量为mg的铜丝灼烧变黑后,立即放入下列物质中,铜丝变红且质量不变的是( )
| A. | CH3COOH | B. | NaOH溶液 | C. | CH3CH2OH | D. | 稀HNO3 |
6.下列说法不正确的是( )
| A. | 油脂能发生皂化反应 | B. | 蛋白质水解的最终产物是氨基酸 | ||
| C. | 纤维素不能发生水解反应 | D. | 淀粉完全水解的产物是葡萄糖 |
13.将Cl2通入自来水中杀菌消毒,主要是利用了Cl2和H2O生成的HClO的( )
| A. | 强氧化性 | B. | 酸性 | C. | 还原性 | D. | 稳定性 |
3.元素性质呈现周期性变化的根本原因是( )
| A. | 元素的原子量逐渐增大 | B. | 核外电子排布呈周期性变化 | ||
| C. | 核电荷数逐渐增大 | D. | 元素化合价呈周期性变化 |
9.利尿酸的结构简式如下图.下列有关利尿酸的说法不正确的是( )


| A. | 分子式是C13H14O4Cl2 | |
| B. | 一定条件下能发生消去反应 | |
| C. | -定条件下能发生加聚反应 | |
| D. | 1mol利尿酸最多能与5molH2发生加成反应 |
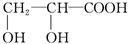 乙:
乙: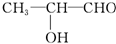
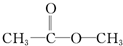 丁:
丁: