МвДҝДЪИЭ
іЈОВПВKMnO4Сх»ҜЕЁHClөД·ҙУҰ·ҪіМКҪИзПВЈә2KMnO4 Ј«16HClЈЁЕЁЈ©=2KClЈ«2MnCl 2Ј«5Cl 2ЎьЈ«8H2O
ЈЁ1Ј©УГЎ°Л«ПЯЗЕ·ЁЎұұкГч·ҙУҰЦРөзЧУЧӘТЖөД·ҪПтәНКэДҝЎЈ
ЈЁ2Ј©УЦТСЦӘ Ј¬ҪбәПТФЙП·ҙУҰФӯАнЈ¬ФтMnO2ЎўKMnO4ЎўCl2өДСх»ҜРФУЙЗҝөҪИхөДЛіРтКЗЈә ЎЈ
Ј¬ҪбәПТФЙП·ҙУҰФӯАнЈ¬ФтMnO2ЎўKMnO4ЎўCl2өДСх»ҜРФУЙЗҝөҪИхөДЛіРтКЗЈә ЎЈ
ЈЁ3Ј©ИфУР63.2gёЯГМЛбјШІОјУ·ҙУҰЈ¬Фтұ»Сх»ҜөДHClөДОпЦКөДБҝОӘ molЈ¬ІъЙъөДCl2ФЪұкЧјЧҙҝцПВөДМе»эОӘ LЎЈ
ЈЁ1Ј©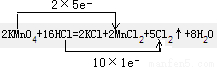 ЈЁ2Ј©KMnO4 MnO2 Cl2 ЈЁ3Ј©2 22.4
ЈЁ2Ј©KMnO4 MnO2 Cl2 ЈЁ3Ј©2 22.4
ЎҫҪвОцЎҝ
КФМв·ЦОцЈәЈЁ1Ј©Л«ПЯЗЕ·Ёұкіц·ҙУҰЦРөзЧУөГК§КэДҝОӘ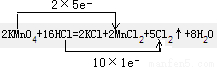 Ј»
Ј»
ЈЁ2Ј©2KMnO4 Ј«16HClЈЁЕЁЈ©=2KCl Ј«2MnCl 2Ј«5Cl 2Ўь Ј«8H2OҙЛ·ҙУҰЦЖИЎCl2І»РиТӘМхјюЈ¬¶шФЪ·ҙУҰ ЦРТӘјУИИЈ¬ЗТMnO2 КЗСх»ҜјБЈ¬ Cl2КЗСх»ҜІъОпЎЈЛщТФУРСх»ҜРФKMnO4 >MnO2 >Cl2
ЦРТӘјУИИЈ¬ЗТMnO2 КЗСх»ҜјБЈ¬ Cl2КЗСх»ҜІъОпЎЈЛщТФУРСх»ҜРФKMnO4 >MnO2 >Cl2
ЈЁ3Ј©ёЯГМЛбјШөДБҝЎўВИЖшөДБҝТФј°ПыәДөДСОЛбЦ®јдөД№ШПөОӘЈә2KMnO4Ў«5Cl2Ў«16HClЈ¬ұ»Сх»ҜөДСОЛбәНІОјУ·ҙУҰөДСОЛбөДБҝЦ®ұИОӘЈә10 :16 ЈҪ5 :8 Ј¬63.2g ЈЁјҙ0.4molЈ©KMnO4НкИ«·ҙУҰКұЈ¬ІъЙъөДCl2ОӘ1.0molЈ¬ФЪұкЧјЧҙҝцПВөДМе»эОӘ1.0molЎБ22.4L/mol=22.4LЈ¬ПыәДөДHClОӘ3.2molЈ¬ұ»Сх»ҜөДHClОӘ2.0mol.
ҝјөгЈәұҫМвҝјІйСх»Ҝ»№Фӯ·ҙУҰЦРөДУР№ШёЕДоәНөзЧУЧӘТЖЦӘК¶

 ИэРВҝміөҪрЕЖЦЬЦЬБ·ПөБРҙр°ё
ИэРВҝміөҪрЕЖЦЬЦЬБ·ПөБРҙр°ё