题目内容
2.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下列是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法.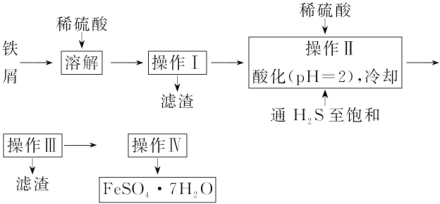
已知:室温下饱和 H2S溶液的 pH 约为3.9,SnS沉淀完全时溶液的 pH 为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH 为5.5.
(1)操作Ⅱ,在溶液中用硫酸酸化至 pH=2的目的是使Sn2+沉淀完全,防止Fe2+生成沉淀.
(2)操作Ⅳ的顺序依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②降低洗涤过程中FeSO4•7H2O的损耗.
(4)测定绿矾产品中Fe2+含量的方法是
a.称取一定质量的绿矾产品,配制成250.00mL溶液;
b.量取25.00mL 待测溶液于锥形瓶中;
c.用硫酸酸化的 0.010 00mol•L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
滴定时发生反应的离子方程式为5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
①用硫酸酸化的 0.010 00mol•L-1KMnO4溶液滴定时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液,溶液变成浅红色且半分钟内不褪色;
②若用上述方法测定的样品中FeSO4•7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有样品中存在少量的杂质或样品部分被氧化.
分析 铁屑加入稀硫酸生成硫酸亚铁、硫酸锡,过滤后得到滤液,将滤液加入稀硫酸酸化,并通入硫化氢,可生成SnS沉淀并防止亚铁离子被氧化,过滤后得到滤液为硫酸亚铁,经蒸发浓硫酸、冷却结晶、过滤可得到FeSO4•7H2O,
(1)FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节溶液PH=2为了除去杂质离子Sn2+;
(2)操作IV的目的是从滤液中析出绿矾晶体,利用蒸发浓缩,结晶洗涤得到晶体;
(3)操作IV得到的绿矾晶体用少量冰水洗涤目的是洗去表面杂质,温度降低绿矾溶解度降低,减少绿矾晶体的损失;
(4)高锰酸钾为紫色,与亚铁离子发生氧化还原反应,如含有杂质,或样品部分被氧化,则测定含量偏低.
解答 解:(1)FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,
故答案为:使 Sn2+沉淀完全,防止 Fe2+生成沉淀;
(2)溶液中得到晶体,需要对溶液进行加热蒸发浓缩,结晶析出,过滤洗涤等,所以操作IV的顺序依次为:蒸发浓缩、冷却结晶、过滤、洗涤,
故答案为:蒸发浓缩;冷却结晶;
(3)冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,避免绿矾溶解带来的损失,故答案为:降低洗涤过程中 FeSO4•7H2O的损耗;
(4)①滴定实验达到终点时,滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色,
故答案为:滴加最后一滴KMnO4溶液,溶液变成浅红色且半分钟内不褪色;
②高锰酸钾为紫色,与亚铁离子发生氧化还原反应,如含有杂质,或样品部分被氧化,则测定含量偏低,
故答案为:样品中存在少量的杂质或样品部分被氧化.
点评 本题考查了铁盐亚铁盐的性质应用,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,题目着重于分离混合物的实验方法设计和分析判断的考查,注意把握滴定实验的分析判断,数据计算,误差分析的方法,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案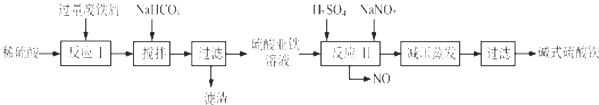
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:回答下列问题:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(2)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O,在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2的作用是2H2O+4NO+O2=4HNO3.(用化学方程式表示)
(3)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是防止蒸发时温度过高,碱式硫酸铁进一步水解生成Fe(OH)3.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.(填写字母)
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.
| A. | 为测定熔融氢氧化钠的导电性,将氢氧化钠固体放在石英坩埚中加热熔化 | |
| B. | 将一定量的Na2O2和NaHCO3的混合物放在一密闭容器中充分加热后,所得固体中一定含有Na2CO3 | |
| C. | 硫酸、纯碱、偏铝酸钠和过氧化钠分别属于酸、碱、盐和氧化物 | |
| D. | 将足量的稀盐酸加到Mg、AlCl3、NaAlO2组成的混合物中,只能发生一种反应 |
| A. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HC1O | |
| B. | NH4HSO3溶液与足量NaOH溶液反应:NH4++OH-═NH3↑+H2O | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 将1 mol•L-1NaAlO2溶液和1.5 mol•L-1的HC1溶液等体积混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ |
 叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.
叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.
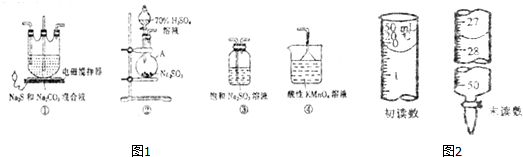


 .
.
 .
.