题目内容
14.2011年4月台湾曝出的增塑剂风波一度让人们“谈塑色变”.常用的增塑剂如下: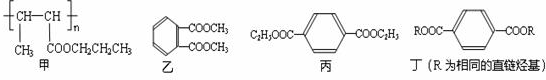
请回答下列问题:
(1)下列对甲的叙述正确的是B(填选项字母)
A.甲能使Br2的CCl4溶液褪色
B.甲的单体是CH3CH=CHCOOCH2CH2CH3
C.1mol甲最多能与1mol NaOH发生水解反应
D.甲能发生酯化反应、取代反应、消去反应、加成反应
(2)丙中含有的官能团名称是酯基.
(3)乙的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式
 .
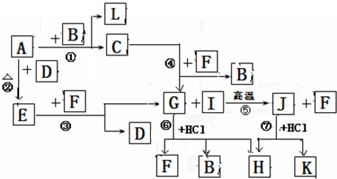
.(4)已知通过燃烧法确定丁的含氧量(质量分数)为23%.以某烃A为原料合成该塑料增塑剂的流程如下:
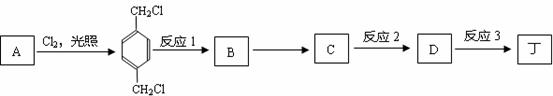
①反应1的反应条件是NaOH水溶液、加热.
②反应3的反应类型是氧化反应.
③反应2的化学方程式是
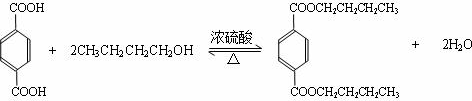 .
.④A中最多有14个原子共平面.
分析 (1)甲中含有酯基,能发生水解反应;
(2)丙中含有酯基;
(3)乙的同分异构体不含甲基;
(4)丁的含氧量(质量分数)为23%,丁分子中有四个氧原子,所以丁的相对分子质量为$\frac{64}{23%}$=278,所以丁中每个烃基的相对分子质量为57,R为直链烃基,所以烃基为-CH2CH2CH2CH3,丁为对苯二甲酸丁酯,由合成路线可知,D为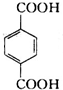 ;A与氯气在光照的条件下发生取代反应生成
;A与氯气在光照的条件下发生取代反应生成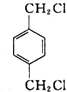 ,故A为
,故A为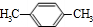 ,
, 在NaOH水溶液条件下生成水解反应生成B,B为
在NaOH水溶液条件下生成水解反应生成B,B为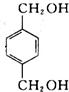 ,B在金属铜或银作催化剂、加热条件下,被氧气氧化性生成C为
,B在金属铜或银作催化剂、加热条件下,被氧气氧化性生成C为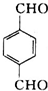 ,进一步发生氧化反应生成D,D发生酯化反应生成对苯二甲酸丁酯.
,进一步发生氧化反应生成D,D发生酯化反应生成对苯二甲酸丁酯.
解答 解:(1)A.甲中不含碳碳不饱和键或醛基,则不能使Br2的CCl4溶液褪色,故错误;
B.根据甲的结构简式知,将甲中两个半键相连得到甲的单体是CH3CH=CHCOOCH2CH2CH3,故正确;
C.1mol甲中含有nmol酯基,则最多能与nmol NaOH发生水解反应,故错误;
D.甲含有酯基,则甲能发生取代反应或水解反应,故错误;
故选B;
(2)丙中官能团是酯基,故答案为:酯基;
(3)乙的同分异构体不含甲基,则乙的同分异构体为 ,
,
故答案为: ;
;
(4)丁的含氧量(质量分数)为23%,丁分子中有四个氧原子,所以丁的相对分子质量为$\frac{64}{23%}$=278,所以丁中每个烃基的相对分子质量为57,R为直链烃基,所以烃基为-CH2CH2CH2CH3,丁为对苯二甲酸丁酯,由合成路线可知,D为 .A与氯气在光照的条件下发生取代反应生成
.A与氯气在光照的条件下发生取代反应生成 ,故A为
,故A为 ,
, 在NaOH水溶液条件下生成水解反应生成B,B为
在NaOH水溶液条件下生成水解反应生成B,B为 ,B在金属铜或银作催化剂、加热条件下,被氧气氧化性生成C为
,B在金属铜或银作催化剂、加热条件下,被氧气氧化性生成C为 ,进一步发生氧化反应生成D,D发生酯化反应生成对苯二甲酸丁酯,
,进一步发生氧化反应生成D,D发生酯化反应生成对苯二甲酸丁酯,
①根据上面的分析可知,反应1的反应条件是NaOH水溶液、加热,
故答案为:NaOH水溶液、加热;
②根据上面的分析可知,反应2的反应类型是氧化反应,
故答案为:氧化反应;
③反应3的化学方程式是 ,
,
④ ,A中连接苯环的原子都共平面,每个甲基中与甲基上C原子共平面是H原子是1个,所以A中最多有14个原子共平面,故答案为:14.
,A中连接苯环的原子都共平面,每个甲基中与甲基上C原子共平面是H原子是1个,所以A中最多有14个原子共平面,故答案为:14.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,明确官能团及其性质关系及物质之间的转化是解本题关键,易错点是1mol甲含有酯基的个数及对二甲苯中共平面原子个数判断,题目难度中等.

| A. | H2O2、Na2O2都属于过氧化物,都存在非极性共价键 | |
| B. | 1mol H2O2在参加反应时可能转移lmol或2mol电子 | |
| C. | H2O2在酶作用下催化分解,随着温度的升高,分解速率持续加快 | |
| D. | H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似、与SO2不同 |
| A. | 盐不能电离出阳离子 | B. | 盐不能电离出阴离子 | ||
| C. | 盐不能电离出H+或OH- | D. | 盐不能电离出共同的离子 |
| v(mol•L-1•s-1) | c(H2)(mol•L-1) | c(Cl2)(mol•L-1) |
| 1.0k | 1.0 | 1.0 |
| 2.0k | 2.0 | 1.0 |
| 4.0k | 2.0 | 4.0 |
| A. | m=1,n=1 | B. | m=$\frac{1}{2}$,n=$\frac{1}{2}$ | C. | m=$\frac{1}{2}$,n=1 | D. | m=1,n=$\frac{1}{2}$ |
 .
.