题目内容
14.下列电子式正确的是( )| A. | 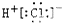 | B. | 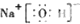 | C. | 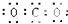 | D. | 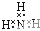 |
分析 从离子化合物和共价化合物的电子式书写方法确定电子式书写是否正确,用电子式表示离子键形成的物质的结构与表示共价键形成的物质的结构的不同点:(1)电荷:用电子式表示离子键形成的物质的结构需标出阳离子和阴离子的电荷;而表示共价键形成的物质的结构不能标电荷.(2)[](方括号):离子键形成的物质中的阴离子需用方括号括起来,而共价键形成的物质中不能用方括号.
解答 解:A、氯化氢属于共价化合物,分子中存在一个H-Cl键,氯原子最外层达到8个电子,氯化氢正确的电子式为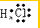 ,故A错误;
,故A错误;
B、氢氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,钠离子直接用离子符号表示,氢氧根离子需要标出最外层电子,氢氧化钠的电子式为: ,故B正确;
,故B正确;
C、CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故C错误;
,故C错误;
D、NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ,故D错误,
,故D错误,
故选B.
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.

练习册系列答案
相关题目
4.化学已渗透到人类生活的方方面面,下列说法正确的是( )
| A. | 离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜 | |
| B. | 向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量 | |
| C. | “低碳生活”倡导生活中尽量减少耗能,从而减少CO2排放 | |
| D. | 铝表面有一层致密的氧化物薄膜,故铝制容器可用来腌制咸菜等 |
5.要除去下列各组物质中的少量杂质,所选试剂和方法不可行的是( )
| 选项 | 物质 | 杂质 | 试剂、方法 |
| A | O2 | 水蒸气 | 通过浓H2SO4洗气 |
| B | MnO2 | 炭粉 | 在空气中灼烧 |
| C | KCl溶液 | BaCl2 | 加入适量的Na2SO4溶液,过滤 |
| D | FeSO4溶液 | CuSO4 | 加入足量铁屑,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
9.下列物质中,含有极性键的是( )
| A. | 单质碘 | B. | 氯化镁 | C. | 溴化钾 | D. | 水 |
19.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 26g乙炔所含共用电子对数目为3NA | |
| C. | 标准状况下,11.2 L CCl4所含分子数为0.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
3.三氟化氮(NH3)是一种无色无味的气味,它是氨气(NH3)和氟(F2)在一定条件下发生反应4NH3+3F2═NF3+3NH4F得到的.下列关于NF3的叙述正确的是( )
| A. | NF3中N呈+3价 | B. | NF3的还原性比NH3强 | ||
| C. | NF3的氧化性比F2强 | D. | NF3是离子化合物 |
4.实验室中,要使AlCl3溶液中的Al3+离子全部沉淀出来,最适宜用的试剂是( )
| A. | 氨水 | B. | Ba(OH)2 溶液 | C. | 盐酸 | D. | NaOH溶液 |
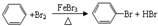 ,预测该芳香烃能(填“能”或“不能”)发生该类反应.
,预测该芳香烃能(填“能”或“不能”)发生该类反应. b.
b.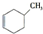 c.
c.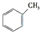
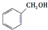 c.
c.

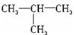 .
.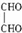 .
.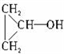 .
.