题目内容
按要求完成下列各题
(1)1g氢气完全燃烧生成液态水放热142.9kJ,写出氢气燃烧热的热化学方程式:
(2)已知水溶液中存在CH3COOH?CH3COO-+H+若加水稀释,c(OH-) 增大、减小或不变,下同),加入冰醋酸,醋酸的电离程度 ,平衡向 移动.
(3)写出燃料电池甲醚(C2H6O)在碱性条件下的负极反应式: .
(1)1g氢气完全燃烧生成液态水放热142.9kJ,写出氢气燃烧热的热化学方程式:
(2)已知水溶液中存在CH3COOH?CH3COO-+H+若加水稀释,c(OH-)
(3)写出燃料电池甲醚(C2H6O)在碱性条件下的负极反应式:
考点:热化学方程式,电极反应和电池反应方程式,弱电解质在水溶液中的电离平衡
专题:化学反应中的能量变化,电离平衡与溶液的pH专题,电化学专题
分析:(1)1mol水的质量为18g,根据1g氢气完全燃烧生成液态水放热142.9kJ计算出18g氢气完全燃烧生成液态水放出的热量,然后根据书写热化学方程式的原则写出氢气燃烧热的热化学方程式;
(2)稀释过程中溶液中氢离子浓度减小,水的离子积不变,则溶液中氢氧根离子浓度增大;加入冰醋酸后醋酸浓度增大,醋酸的电离程度减小,平衡向着正向移动;
(3)负极甲醇失去电子 发生氧化反应,碱性条件下生成碳酸根离子和水,甲醇写出电极反应式.
(2)稀释过程中溶液中氢离子浓度减小,水的离子积不变,则溶液中氢氧根离子浓度增大;加入冰醋酸后醋酸浓度增大,醋酸的电离程度减小,平衡向着正向移动;
(3)负极甲醇失去电子 发生氧化反应,碱性条件下生成碳酸根离子和水,甲醇写出电极反应式.
解答:
解:(1)1g氢气燃烧生成液态水,放出142.9kJ热量,1mol氢气的质量为18g,则1mol氢气燃烧生成液态水,放出的热量为142.9kJ×2=285.8kJ,所以△H=-285.8kJ/mol,氢气燃烧热的热化学方程式:H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ/mol,
故答案为:H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ/mol;
(2)醋酸中加水稀释后,醋酸的电离程度增大,但是溶液中氢离子浓度减小,根据水的离子积不变可知,溶液中氢氧根离子浓度增大;加入醋酸,醋酸的浓度增大,醋酸的电离程度减小,电离平衡向右移动,
故答案为:减小;减小;右;
(3)燃料电池甲醚(C2H6O)在碱性条件下,负极甲醇失去电子生成碳酸根离子和水,该燃料电池的负极反应式:C2H6O+16OH--12e-=2CO32-+11H2O,
故答案为:C2H6O+16OH--12e-=2CO32-+11H2O.
故答案为:H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ/mol;
(2)醋酸中加水稀释后,醋酸的电离程度增大,但是溶液中氢离子浓度减小,根据水的离子积不变可知,溶液中氢氧根离子浓度增大;加入醋酸,醋酸的浓度增大,醋酸的电离程度减小,电离平衡向右移动,
故答案为:减小;减小;右;
(3)燃料电池甲醚(C2H6O)在碱性条件下,负极甲醇失去电子生成碳酸根离子和水,该燃料电池的负极反应式:C2H6O+16OH--12e-=2CO32-+11H2O,
故答案为:C2H6O+16OH--12e-=2CO32-+11H2O.
点评:本题考查了热化学方程式的书写、弱电解质的电离平衡及其影响、燃料电池中电极反应式的书写,题目难度中等,注意掌握热化学方程式的概念及书写方法,明确弱电解质的电离平衡的影响因素,能够根据原电池工作原理正确书写电极反应式.

练习册系列答案
相关题目
下列有机物的命名正确的是( )
| A、2-乙基丁烷 |
| B、3,3-二甲基丁烷 |
| C、3-甲基-2-丁烯 |
D、 1,4-二甲苯 1,4-二甲苯 |
 将红热固体单质甲放在显黄色的溶液乙中剧烈反应,产生混合气体A,A在常温下(不与空气接触)有如下变化:
将红热固体单质甲放在显黄色的溶液乙中剧烈反应,产生混合气体A,A在常温下(不与空气接触)有如下变化: 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示:
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示:
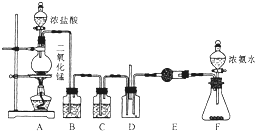 某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应.其中A、F为氯气和氨气的发生装置,D为纯净、干燥的氯气与氨气反应的装置.
某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应.其中A、F为氯气和氨气的发生装置,D为纯净、干燥的氯气与氨气反应的装置. 水杨酸具有防腐杀菌作用,还有祛除汗臭、止痒消肿、止痛消炎等功能,主要用于花露水、痱子水以及一些水类化妆品.水杨酸的结构简式如图所示,请回答下列问题.
水杨酸具有防腐杀菌作用,还有祛除汗臭、止痒消肿、止痛消炎等功能,主要用于花露水、痱子水以及一些水类化妆品.水杨酸的结构简式如图所示,请回答下列问题.